Szkodliwość organizmów grzybopodobnych i sposoby zwalczania w akwakulturze
OGP czyli organizmy grzybopodobne (lub protisty grzybopodobne; ang. FLO – fungus like-organisms) to nieformalna grupa organizmów, zaliczanych, obok grzybów właściwych, do MYCOBIOTA, organizmów które są przedmiotem badań mykologii.
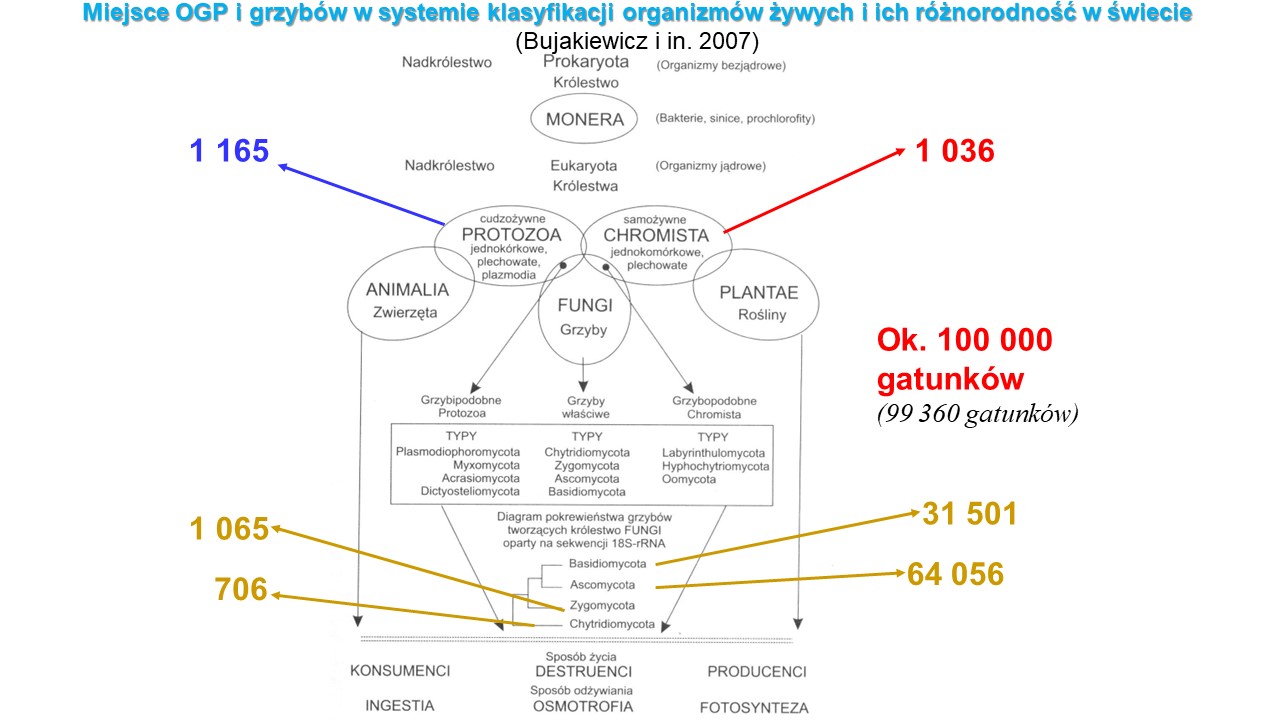
Pozycja taksonomiczna OGP i grzybów w klasyfikacji świata ożywionego ciągle jest rewidowana i korygowana w oparciu o coraz to nowe dane dotyczące ich budowy czy fizjologii. Stąd też tych klasyfikacji jest wiele. W każdej z nich dopiero od 1969 roku, niekwestionowane jest wyodrębnienie FUNGI (grzyby) w randze samodzielnego królestwa, równorzędnego królestwom: PLANTAE (rośliny) i ANIMALIA (zwierzęta). Zróżnicowanie morfologiczne, anatomiczne i fizjologiczne w królestwie Fungi, z czasem uzasadniało wyodrębnienie z niego grupy organizmów, mających wiele cech wspólnych, ale też odrębnych, które nazwano OGP, czyli organizmami grzybopodobnymi (protistami grzybopodobnymi) i sklasyfikowano w dwóch królestwach reprezentujących protista: PROTOZOA i CHROMISTA. Protisty mogą być jednokomórkowe lub wielokomórkowe, które często tworzą formy kolonijne. Różnią się między sobą zarówno sposobem odżywiania, jak i poruszania. Wśród protistów są gatunki samożywne (autotrofy) oraz cudzożywne (heterotrofy). Ze względu na budowę, sposób odżywiania się i poruszania wyróżnia się wśród protistów trzy grupy: protisty zwierzęce, roślinopodobne oraz grzybopodobne. Gatunki zaliczane do protistów zwierzęcych są wyłącznie jednokomórkowymi heterotrofami, pobierającymi pokarm na drodze wchłaniania lub endocytozy (pinocytozy lub fagocytozy). Wśród nich wyróżnia się saprobionty, drapieżniki oraz pasożyty. Większość z nich okryta jest dodatkową błoną komórkową, tzw. pellikulą, a w komórkach brak ściany komórkowej. Ich cechą „zwierzęcą” jest zdolność do poruszania się ruchem pełzakowatym (ameboidalnym) albo za pomocą wici lub rzęsek. Protisty roślinopodobne są organizmami jednokomórkowymi, kolonijnymi lub wielokomórkowymi, które mają ścianę komórkową, zbudowaną najczęściej z celulozy. Większość gatunków to autotrofy, przeprowadzające fotosyntezę dzięki obecności chloroplastów. Wśród protistów roślinopodobnych znane są też gatunki zaliczane do miksotrofów, czyli samożywnych w obecności światła, natomiast cudzożywnych przy jego braku. Protisty grzybopodobne to komórczaki, co oznacza, że w każdej komórce zawierają wiele jąder. Podobnie jak komórki protistów roślinopodobnych, komórki OGP otoczone są ścianą komórkową zbudowaną z celulozy. OGP występują w wodzie i wilgotnym środowisku. Wszystkie gatunki zaliczane do tej grupy są heterotrofami – saprobiontami lub pasożytami. Protisty grzybopodobne rozmnażają się przez zarodniki lub gamety. W grupie tej wyróżnia się zarówno gatunki pozbawione umiejętności wykonywania ruchu, jak i aktywnie przemieszczające się ruchem ameboidalnym. Przedstawicielami protistów grzybopodobnych są lęgniowce i śluzowce. Patogeny OGP z rodzajów Saprolegnia, Aphanomyces i Achlya i Branchiomyces, które są najczęściej oportunistycznymi patogenami ryb słodkowodnych i ikry, zarówno w naturalnych ekosystemach jak i komercyjnych gospodarstwach rybnych, przez co stanowią jedno z największych zagrożeń dla globalnego bezpieczeństwa żywnościowego.
Tak więc, w charakterystyce przedstawicieli mycobiota występują pojedyncze cechy łączące tę grupę organizmów z przedstawicielami każdego z innych królestw świata organicznego.
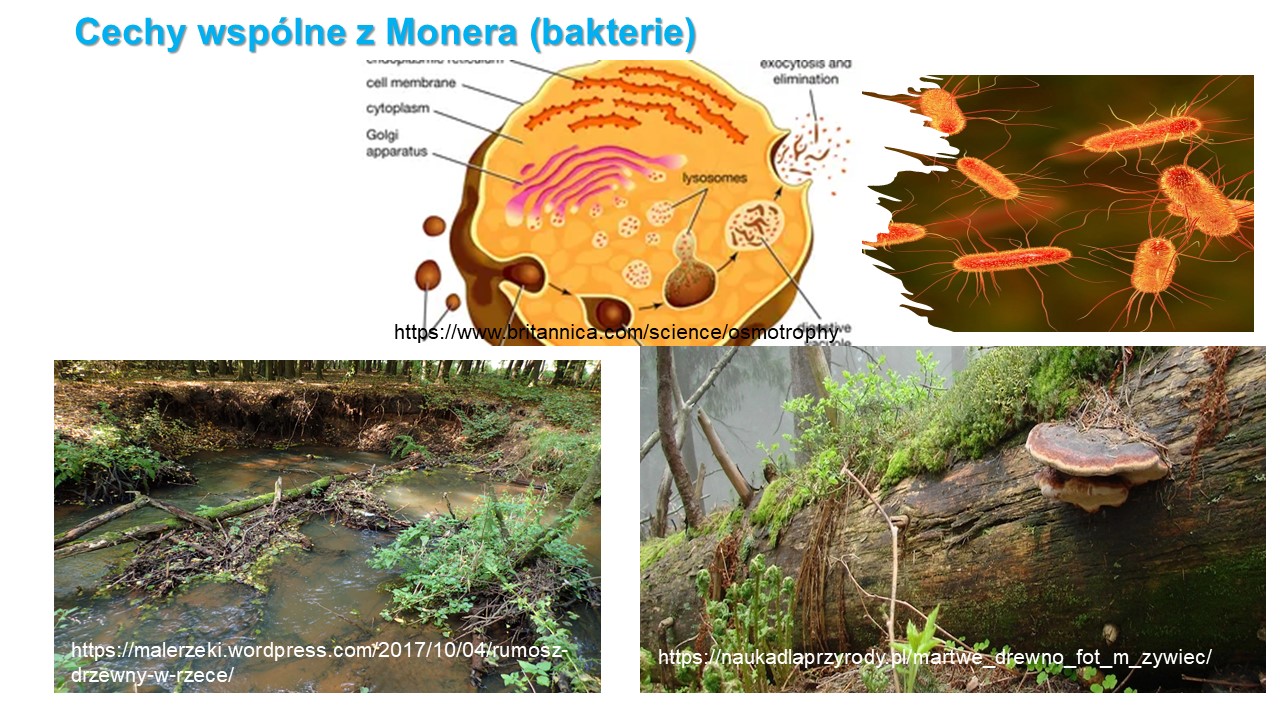
Cechy wspólne z Monera (bakterie)
Odżywianie na zasadzie osmotrofii. Trawią pokarm na zewnątrz ciała, wydzielając do podłoża egzoenzymy. Rozłożone przez te enzymy związki wnikają do strzępek w postaci płynnej i są dalej przerabiane przez endoenzymy.
Rozkład złożonych związków organicznych, związany z uwolnieniem prostych związków dostępnych dla roślin i zwierząt to podstawowa rola OGP i grzybów jako destruentów lub patogenów w ekosystemach.
Mykobiota jako organizmy heterotroficzne nie mają możliwości wytwarzania wielu złożonych związków organicznych i dlatego są CAŁKOWICIE uzależnione od dostępności materiału organicznego pochodzącego od innych organizmów zarówno żywych jak i martwych.
Grzyby i OGP pobierają składniki pokarmowe za pośrednictwem strzępek wegetatywnej grzybni, która stanowi zasadniczą część ich organizmu (czyt. ciała) i najczęściej jest niewidoczna, ukryta w podłożu (drewnie, glebie, tkance roślinnej lub zwierzęcej).
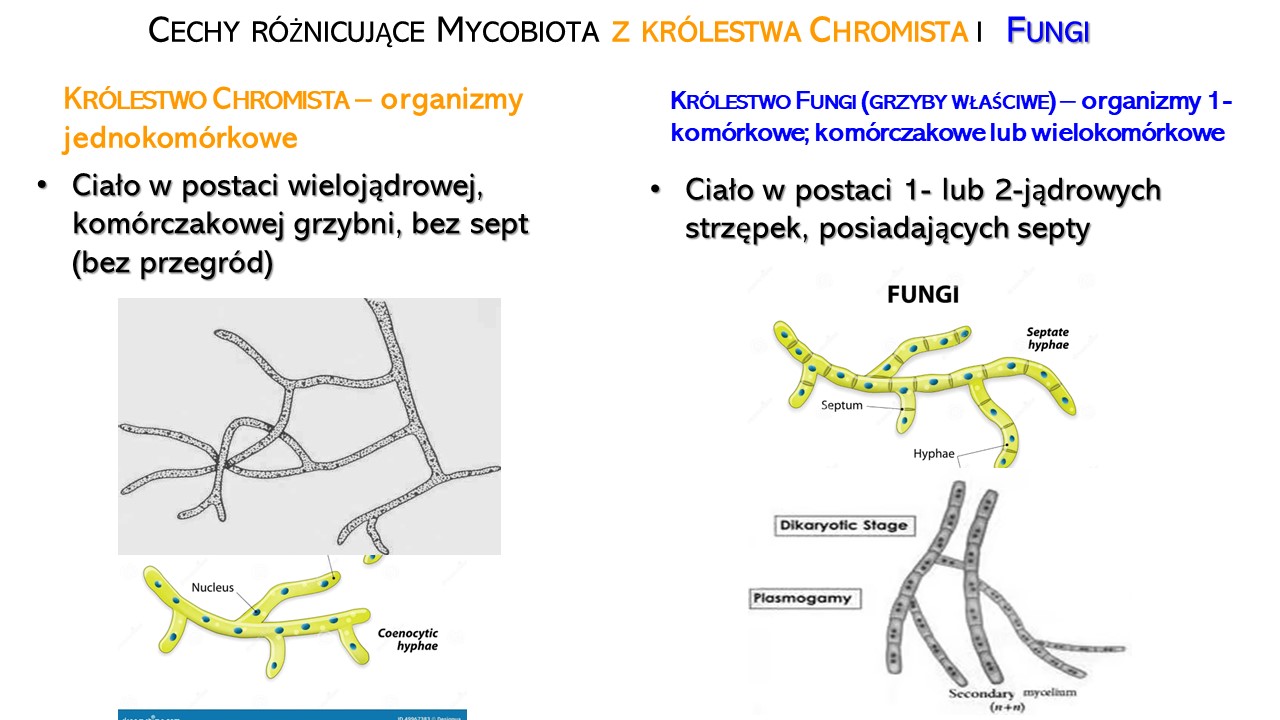
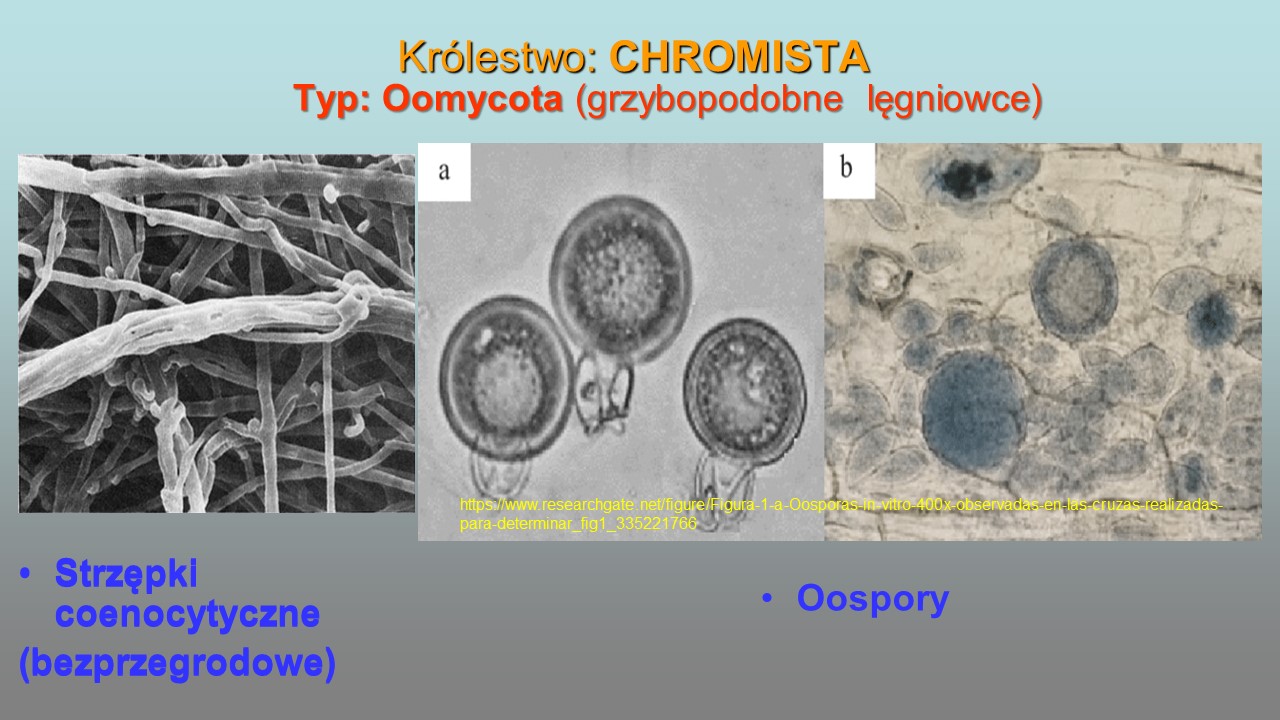
Strzępki (łac. hyphae) to nitkowate elementy, z których zbudowana jest grzybnia (mycellium; plecha), czyli ciało grzybów. Strzępki mają postać wydłużonych, prostych lub pogiętych rurek wypełnionych cytoplazmą, składają się z komórek jednojądrowych lub wielojądrowych zwanych komórczakami.
Grzybnia (mycellium) – plecha stanowiąca ciało grzybów o rozgałęzionej strzępce lub wielu strzępkach. Grzybnia może przyjmować wiele form (postaci) różniących się budową. Są to: pojedyncza komórka ⇒ strzępka ⇒ grzybnia ⇒ owocnik lub przetrwalnik. Wyróżnia się dwa rodzaje grzybni: grzybnię wegetatywną (=substratową; wewnętrzną, wgłębną, podłożową lub pożywkową) , która wnika i przerasta podłoże, czerpiąc z niego wodę i składniki odżywcze oraz grzybnię powietrzną (=rozrodczą, zewnętrzną, powierzchniową), która rozwija się na powierzchni podłoża i umożliwia oddychanie oraz wytwarza struktury służące rozmnażaniu.
Strzępki grzybni mogą posiadać przegrody czyli septy, poprzeczne ściany dzielące strzępkę na komórki. Strzępki z przegrodami nazywane są strzępkami septowanymi, strzępki bez przegród to strzępki nieseptowane (= coenocytycznymi). Septy wzmacniają i stabilizują konstrukcję strzępek oraz spełniają istotną rolę, umożliwiającą zamknięcie odcinka plechy w przypadku uszkodzenia niektórych komórek. Wyłączenie fragmentów plechy nie ma większego wpływu na pozostałą część grzybni , co umożliwia jej dalszy wzrost.
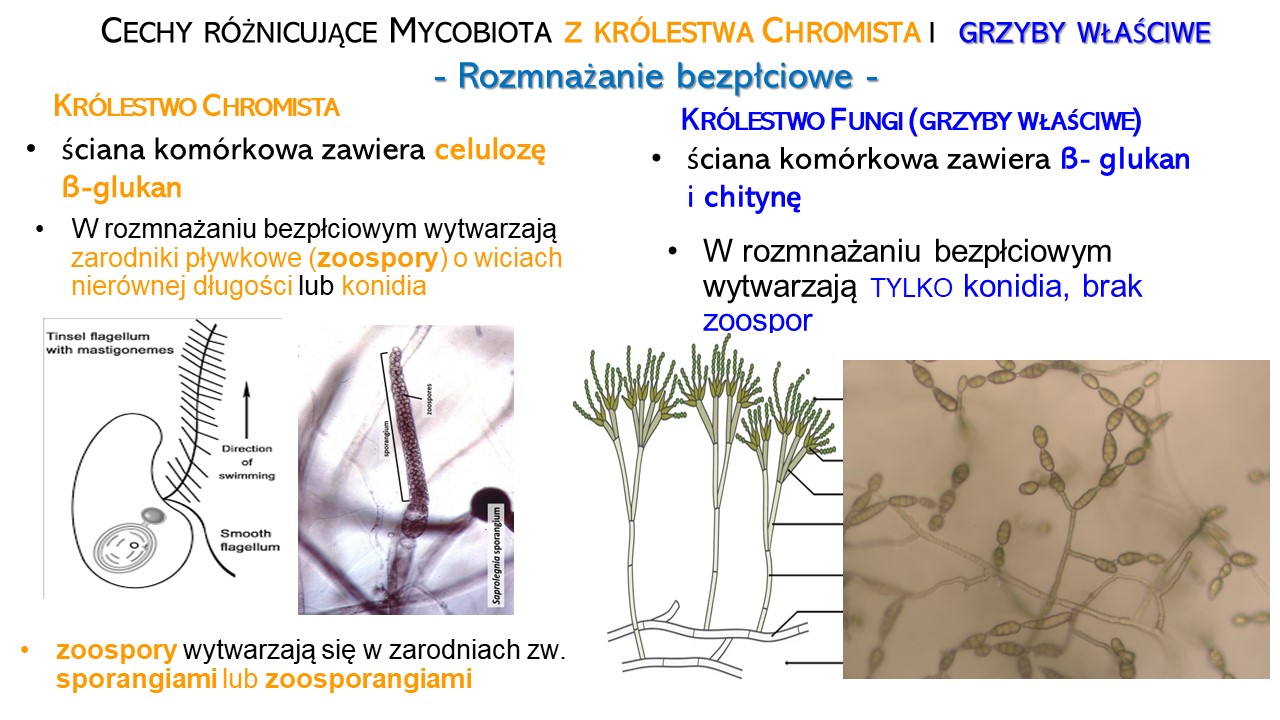
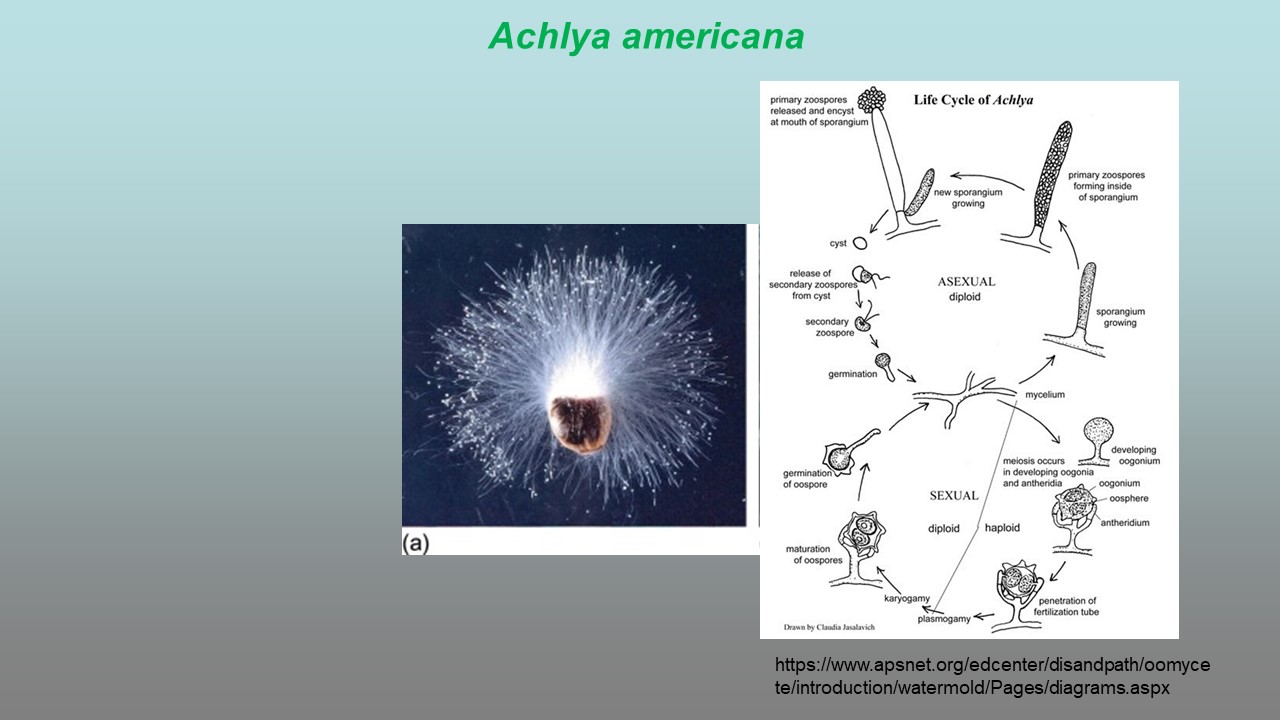
Rozmnażanie bezpłciowe OGP następuje poprzez tworzenie zarodników pływkowych (zoospor). Charakteryzują się one:
– brakiem ściany komórkowej i osłonięte są tylko błoną cytoplazmatyczną,
– poruszają się za pomocą wici, które są organellami ruchu nierównej długości
– tworzą się w zarodniach pływkowych (zoosporangiach) po mitotycznym podziale jądra i fragmentacji protoplastu.
Rozmnażanie bezpłciowe grzybów właściwych następuje poprzez:
– podział komórki lub pączkowanie (formy jednokomórkowe);
– fragmentację plechy (grzyby wielokomórkowe);
– zarodniki konidialne (grzyby wielokomórkowe). Konidia są silnie zróżnicowane morfologicznie występują powszechnie u workowców i grzybów mitosporowych, i rzadko u podstawczaków.
Pierwszym etapem procesu płciowego jest zapłodnienie. OGP i grzyby rozmnażają się płciowo na drodze gamii, żadne z nich nie wytwarzają ruchliwych gamet.
Występują tu następujące sposoby zapłodnienia:
- gametogamia – polega na łączeniu się haploidalnych gamet i wytworzeniu zygoty; występuje u skoczków;
- gametangiogamia – polega na łączeniu się całych gametangiów (które mogą ale nie muszą być zróżnicowane na lęgnie- oogonia i plemnie – antherydia); występuje u wyspecjalizowanych skoczków (Chytridiomycota), sprzężniowych (Zygomycota) i workowców (Ascomycota);
- somatogamia – polega na łączeniu się dwóch haploidalnych wegetatywnych strzępek (określanych jako strzępka + i strzępka – ) należących do dwóch różnych osobników; jest wynikiem redukcji gamet i gametangiów; występuje u podstawkowych (Basidiomycota)
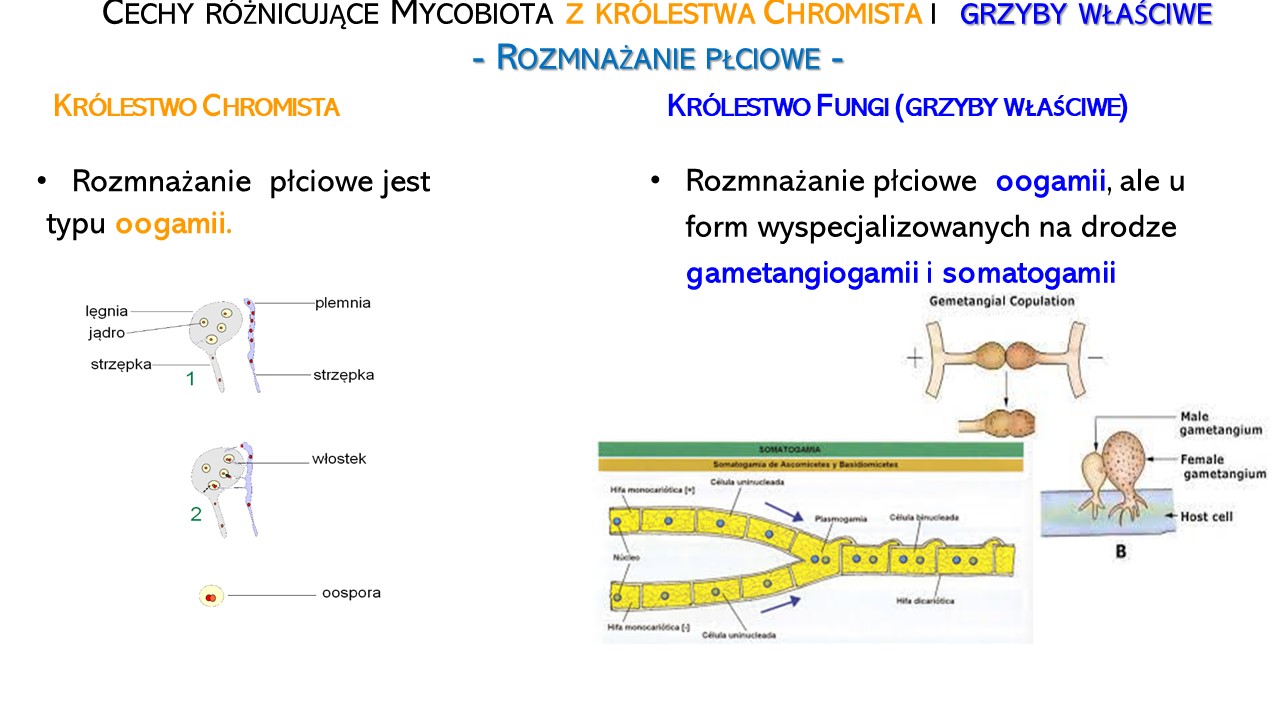
U Chromista efektem rozmnażania płciowego jest tworzenie w oogonium zygoty, czyli diploidalnej oospory, stanowi ona formę zarodnika przetrwalnikowego. OGP nie wytwarzają owocników, w odróżnieniu od grzybów właściwych Fungi, stąd też są to przede wszystkim formy mikroskopowe (tzw. micromycetes).
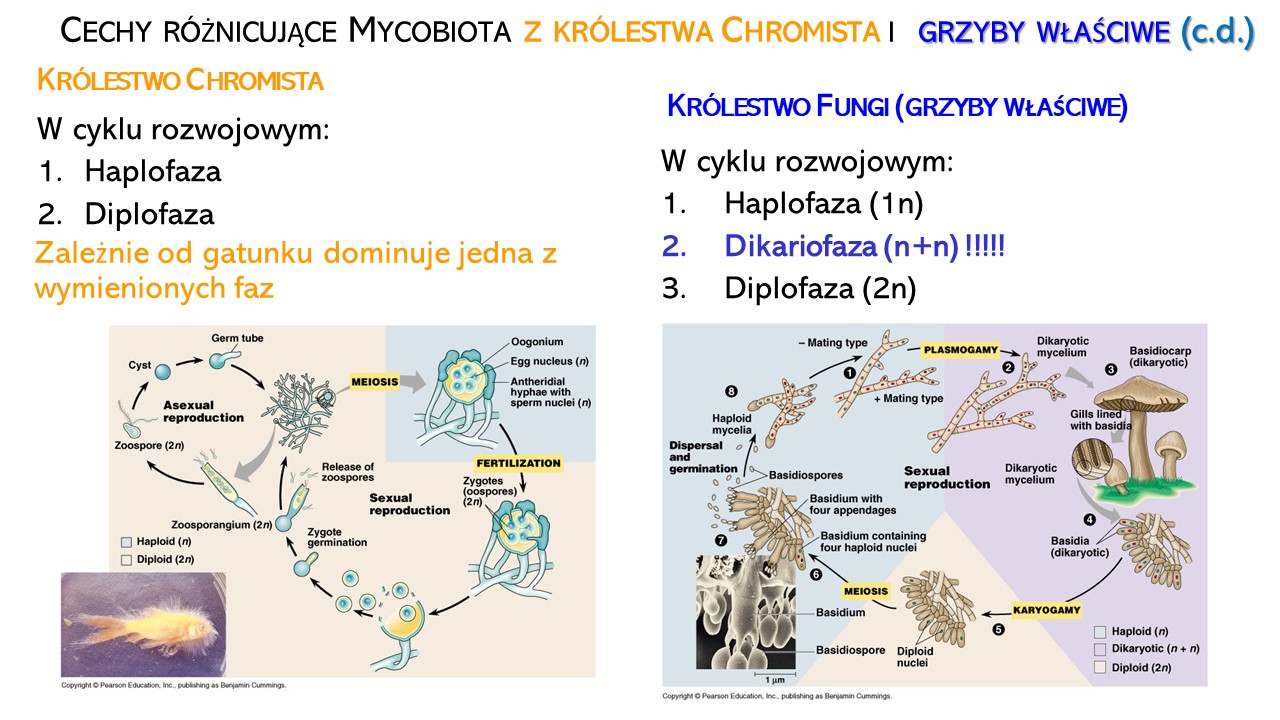
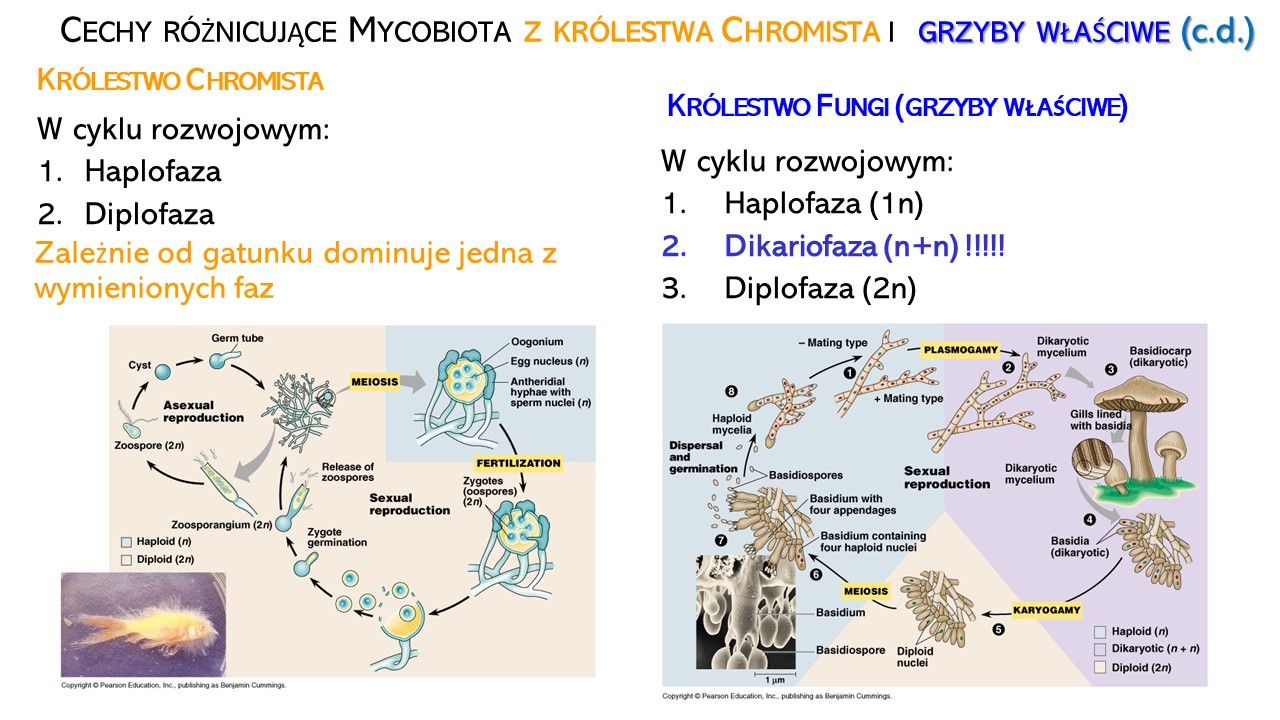
W cyklu rozwojowym mycobiota występuje przemiana pokoleń, czyli naprzemiennie występowanie form rozmnażających się bezpłciowo (aseksualnie) i płciowo (seksualnie). U OGP z królestwa Chromista przemianie pokoleń towarzyszy przemiana faz jądrowych: haplofaza (n) i diplofaza (2n). Zależnie od gatunku dominuje jedna z wymienionych faz.
U grzybów właściwych proces płciowy jest rozdzielony w czasie i przestrzeni, ponieważ w gametangiogamii lub somatogamii najpierw następuje plazmogamia, czyli łączenie się cytoplazm komórek płciowych (bez łączenia się ich jąder). Komórki strzępek rozwijające się po plazmogamii mają po 2 jądra sprzężone (n+n) i stanowią, najdłuższy etap rozwoju – dikariofazę. Dopiero po połączeniu się tych jąder (kariogamia) proces płciowy jest zakończony. Jedyną komórką diploidalną jest worek (u Ascomycota, workowce) lub podstawka (u Basidiomycota, podstawkowe), w których zachodzi mejoza i wytwarzanie haploidalnych mejospor (odpowiednio: askospor lub basidiospor).
Tak wszechstronne przystosowania morfologiczne, anatomiczne i fizjologiczne pozwalają OGP i grzybom opanować wszystkie ekosystemy. Grzyby i OGP występują wszędzie w glebie, wodzie, powietrzu na resztkach organicznych, są więc organizmami ubikwistycznymi. Stąd nasz kontakt z grzybami, choć powszechny, jednak jest w dużym zakresie nieświadomy.
Najwięcej grzybów współtworzy ekosystemy leśne, gdzie związane są ze ściółką oraz występują jako tzw. huby na obumierającym drewnie oczywiście związane są też z glebą.
W 1cm3 gleby jest 20km (!!) cienkich skrzepek grzybni.
Występują też w różnych ontocenozach narządowych ludzi i zwierząt. np. na skórze o powierzchni ok. 2m2 żyje tyle mikroorganizmów ile jest ludzi na Ziemi.
Jelito grube w 1g treści pokarmowej ma ok. biliona mikroorganizmów żywych i zalicza się do najgęściej „zamieszkanych”miejsc na naszej planecie. W każdym przypadku ok. 60-80% stanowią mycobiota.
Istnienie w ukryciu i nagłe wyłanianie się – to właściwość mykobiota, od dawna fascynująca ludzi, a to wszystko dzięki zarodnikom, które stwierdza się w powietrzu na wysokości 5000 m, ale też w morskich głębinach do 4600 m.
W BIOAEROZOLU
- W 1m3 powietrza unosi się od 1000-10 000 zarodników grzybów.
Człowiek każdego dnia wdycha od 10 000 do 20 000 l powietrza, a tym samym dużo zarodników grzybów, co codziennie odpowiada 7 nanogramom DNA grzybów.
W wodzie dominują grzyby drożdżoidalne oraz OGP z królestwa Chromista.
Najważniejsza i najliczniejsza grupa OGP, wywołująca tzw. „pleśniawki” u ikry, ryb i bezkręgowców wodnych to przedstawiciele królestwa Chromista.
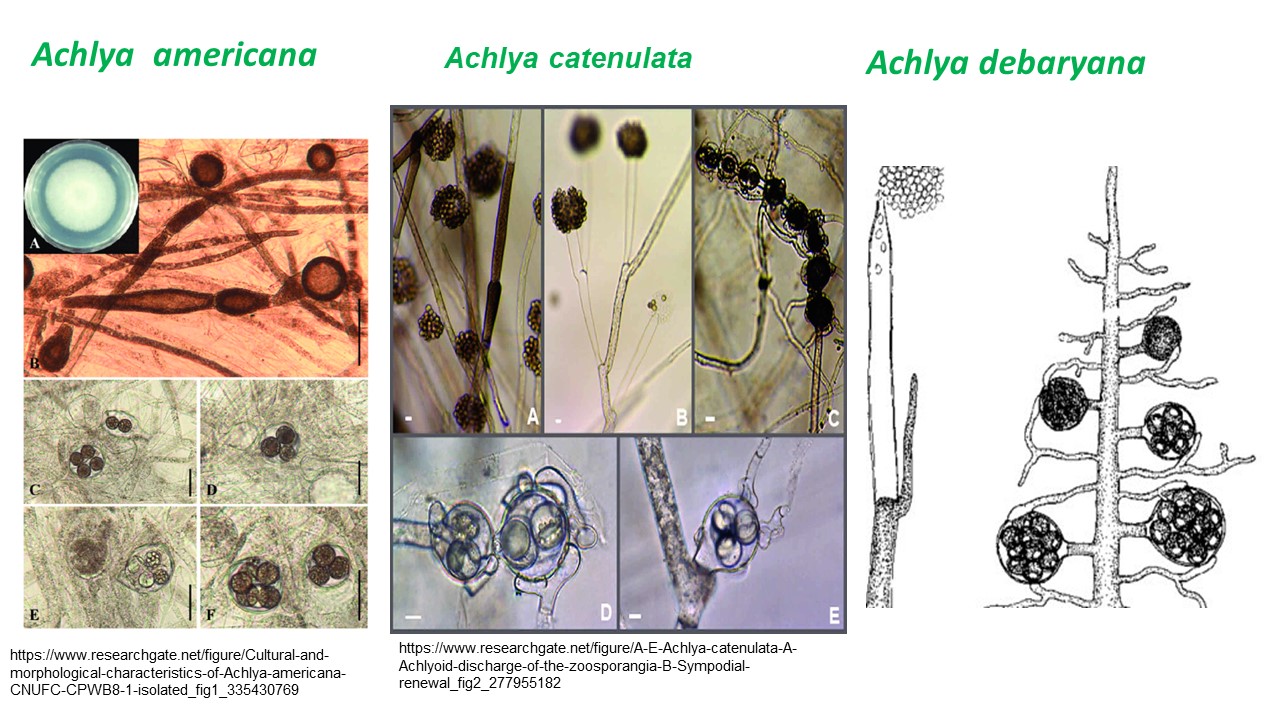
Najważniejsi przedstawiciele Chromista, w których sklasyfikowano ponad 500 gatunków, zdolnych do infekowania licznych żywicieli, w tym ważnych gospodarczo roślin i kręgowców należą do typu Oomycota (grzypopodobnych lęgniowców). Lęgniowce chorobotwórcze dla hydrobiontów to przede wszystkim 5 rodzajów: Achlya, Aphanomyces, Branchiomyces, Saprolegnia i Thraustotheca , reprezentujące rząd Saprolegniales. Stąd choroby wywoływane przez jednego z w/w przedstawicieli to saprolegniozy.
Cechy wyróżniające przedstawicieli typu Oomycota
- Strzępki coenocytyczne (bezprzegrodowe)
- Oospora – zygota otoczona grubą ścianą komórkową. Powstaje w wyniku oogamii, ma diploidalną liczbę chromosomów i pełni funkcję komórki przetrwalnikowej, która po okresie spoczynku lub po przetrwaniu niekorzystnych warunków życiowych może kiełkować.
Najgroźniejsze patogeny roślin reprezentują rodzaje: Phytophthora, Pythium, Aphanomyces, Perosnospora, Bremia, Plasmopara
Najgroźniejszymi zoopatogenami, wywołującymi mykozy ikry, ryb i bezkręgowców wodnych są gatunki z rodzajów: Saprolegnia, Achlya i Aphanomyces.
- Rozmnażanie płciowe na drodze oogamii.
- Rodzaj obupłciowy (jednopienny) – Saprolegnia,
- Rodzaje rozdzielnopłciowe (dwupienne) – Achlya, Aphanomyces astaci.
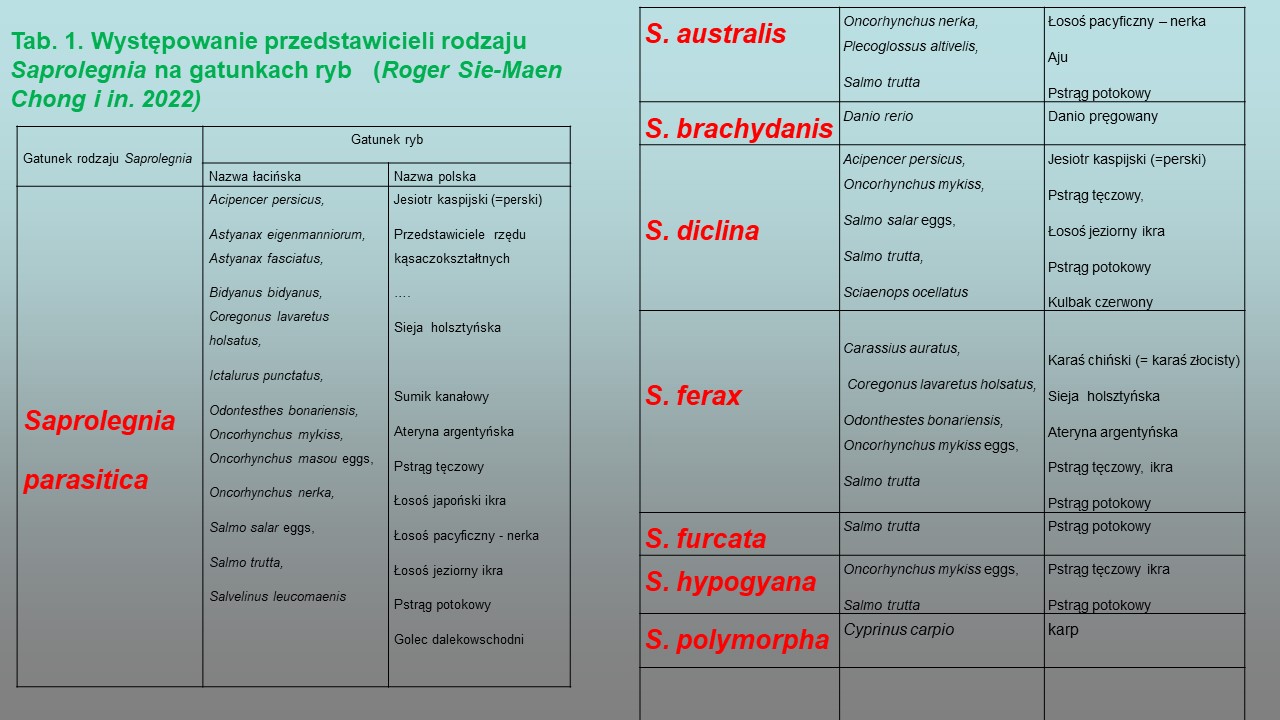
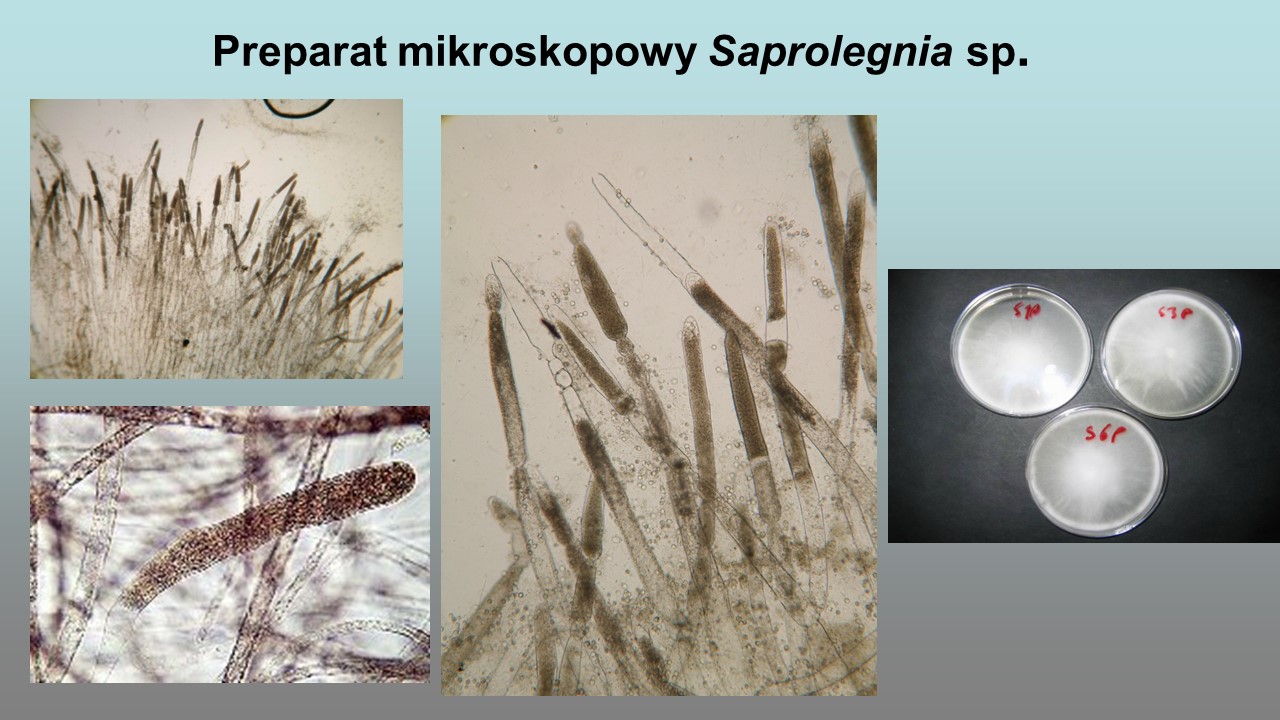
Wśród Oomycota patogenicznych dla hydrobiontów, takich jak: płazy, skorupiaki, owady i ryby, najczęściej saprolegniozę wywołują przedstawiciele z rodzaju Saprolegnia, występujące głównie w wodach słodkich. W rodzaju Saprolegnia sklasyfikowane zostały gatunki według morfologicznych cech płciowych oraz charakterystyki molekularnej powtórzeń rybosomalnego DNA (rDNA). Rozpoznane tą metodą gatunki Saprolegnia to S. diclina, S. ferax, S. australis i S. parasitica. Patogenem wielu gatunków ryb słodkowodnych jest S. parasitica. Inne, najczęściej identyfikowane gatunki Saprolegnia, izolowane z ryb przedstawia tabela 1.
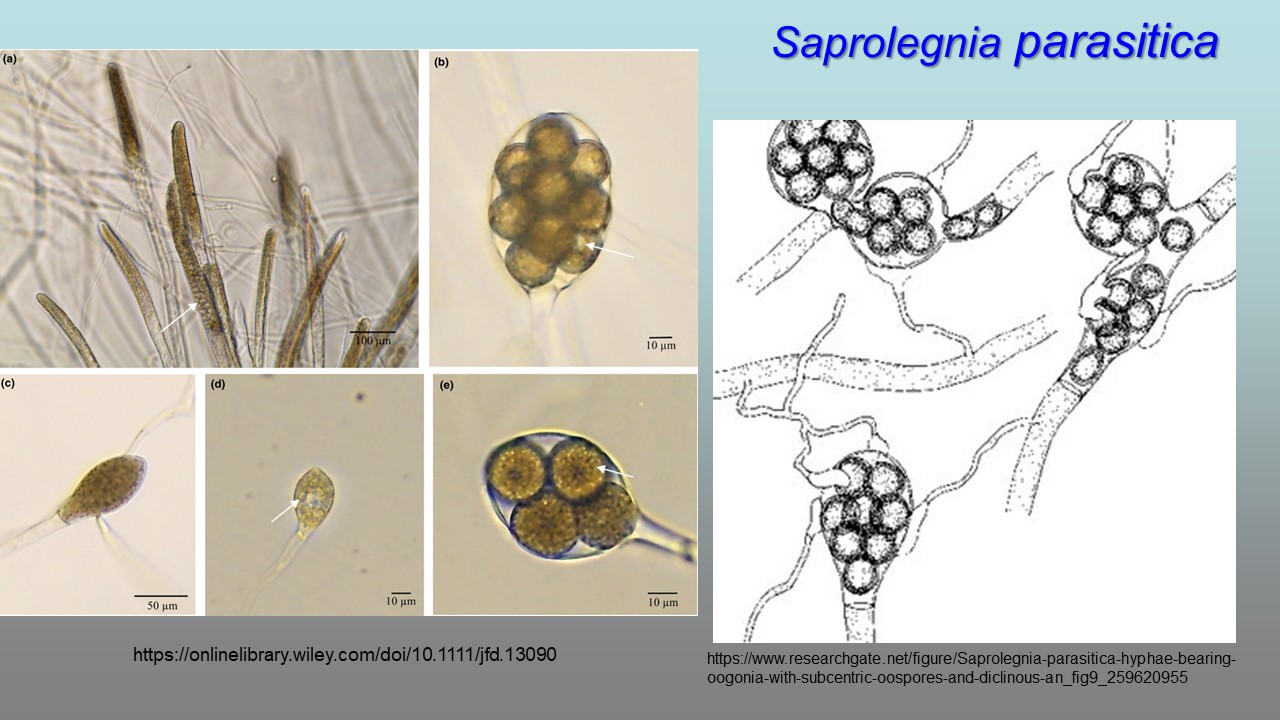
Fotografia z lewej strony: (a) Dojrzewające zarodnie S. parasitica szczep 1; strzałka wskazuje zoospory, które wkrótce zostaną uwolnione. (b) Oogonium S. parasitica z wieloma oosporami w środku; strzałka odnosi się do dojrzałej oospory z kropelką oleju. (c) Dojrzewająca zarodnia S. parasitica. (d) Dojrzała zarodnia S. parasitica szczep 2; strzałka wskazuje zoospory, które wkrótce zostaną uwolnione. (e) Dojrzałe oogonium S. parasitica szczep 3; strzałka wskazuje dojrzałą oosporę z kropelką oleju.
Grzybnia Saprolegnia parasitica jest umiarkowanie rozgałęziona, o szerokości 18–56 µm (średnio 39 µm). Zarodnie cylindryczne, odnawiane wewnętrznie, 150–460 × 20–66 μm (średnio 325 × 52 µm). Cysty o średnicy 10–12 µm (średnio 11 µm). Gemmy nieobecne w kulturach wodnych, jeśli były obecne, to lokalizują się na końcach strzępek, kuliste i pojedyncze. Oogonia głównie boczne, czasami końcowe, o średnicy 86–110 μm. Ściana oogonium gładka. Strzępki z oogoniami są bardzo krótkie. Oospory kuliste, umieszczone w liczbie 8–32 w oogonium i mające 12–29 μm średnicy.
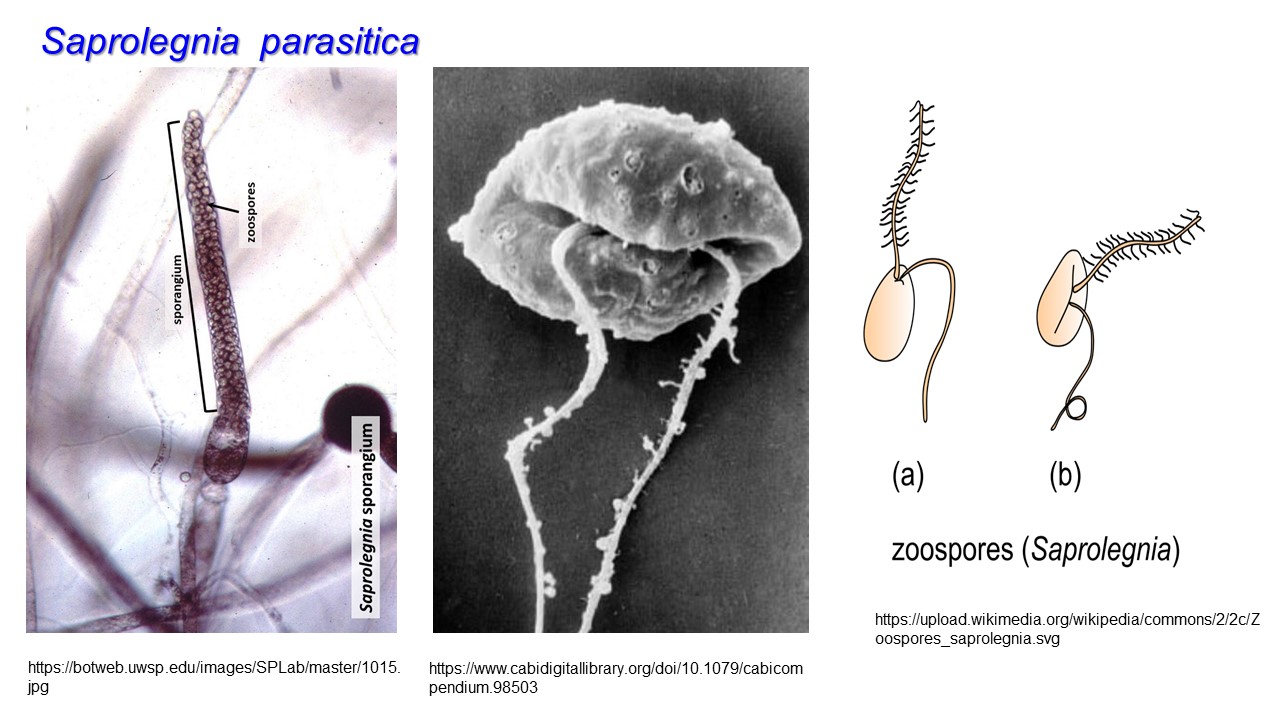
W fazie bezpłciowej Saprolegnia uwalnia pływki (zoospory). Pierwsza pływka w ciągu kilku minut otorbia się, kiełkuje i uwalnia kolejną pływkę. Druga pływka żyje dłużej; porusza się w wodzie szukając pokarmu, a jeśli go nie znajdzie znów otorbia się i uwalnia nową pływkę. Proces ten zwany poliplanetyzmem może powtarzać się kilka razy, u S. parasitica 6-krotnie. Kiedy pływka dzięki zdolnościom chemotaktycznym znajdzie odpowiednie podłoże, otaczającymi ją wiciami przyczepia się do niego i może rozpocząć fazę bezpłciowego lub rozmnażania płciowego. Najbardziej patogenne fenotypy mają na końcach wici małe haczyki, które zwiększają ich zdolność przyczepiania się do ryb.
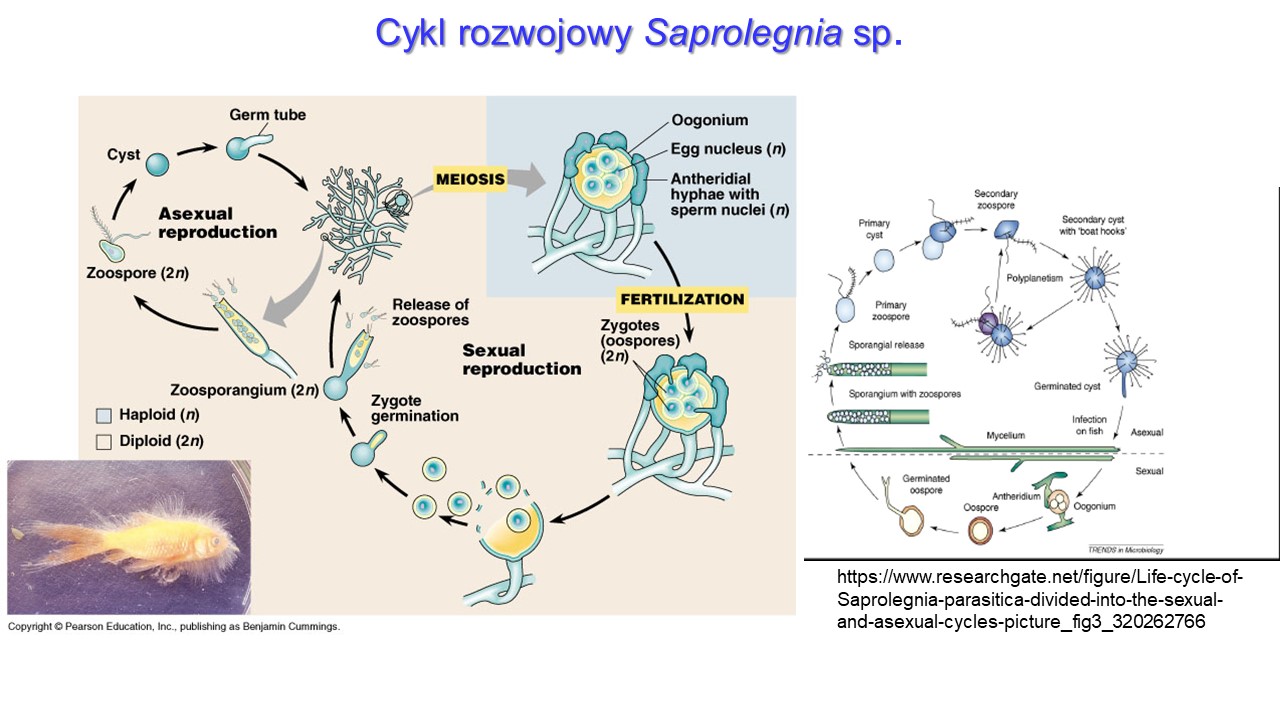
Cykl rozwojowy Saprolegnia na przykładzie S. parasitica przebiega w dwóch stadiach (pokoleniach) bezpłciowym i płciowym, związanych ze przemianą faz jądrowych (schemat po lewej stronie). Stadium bezpłciowe związane jest z wytwarzaniem 2-wiciowych zoospor w, tworzących się na końcach strzępek grzybni – zoosporangiach. Uwalnianjące się bezpośrednio z zoosporangiów tzw. pierwotne zoospory, sporadycznie mogą powodować pierwotną infekcję ryb żywicielskich. Częściej te pierwotne zoospory otorbiają się na żywicielu, tworząc pierwotne cysty, a dopiero później uwalniają 2-wiciowce, bardziej ruchliwe, wtórne zoospory, które uważane są za najważniejsze stadium infekcyjne Saprolegnia. W fazie bezpłciowej następuje powtarzające się, cykliczne pojawienie się zoospor i cyst (tzw. poliplanetyzm), które jest wynikiem niespecyficznych bodźców (tj. mechanicznych lub fizycznych), i w cyklu życiowym S. parasitica może zachodzić nawet 6-krotnie. Tworzenie wtórnych cyst, umożliwia przetrwanie niekorzystnych warunków zewnętrznych i uwolnienie kolejnej generacji zoospor, wówczas gdy warunki będą optymalne dla rozwoju. Nie tylko biologia S. parasitica, związana m.in. z poliplanetyzmen, sprawia, że gatunek ten wyróżnia się największą częstością występowania i patogenicznością, spośród wszystkich należących do rodzaju Saprolegnia, ale także morfologia wici, które mają na końcach małe haczyki zwiększające ich zdolność przyczepiania się do ryb. Kiedy zoospora dzięki zdolnościom chemotaktycznym znajdzie odpowiednie podłoże, otaczającymi je wiciami przyczepia się i może rozpocząć fazę rozmnażania płciowego.
Stadium płciowe odgrywa w epidemiologii Saprolegnia, w tym S. parasitica, zdecydowanie mniejszą rolę, a w warunkach laboratoryjnych występuje rzadko lub go brak. Natomiast w warunkach naturalnych cykl płciowy pojawia się w celu zwiększenia przeżywalności patogenu w niekorzystnych warunkach środowiskowych. Ten etap rozpoczyna się od formowania męskich i żeńskich struktur rozrodczych (gametangiów), czyli odpowiednio anterydium i oogonium. W procesie oogamii, gameta męska – bezwiciowa komórka plemnikowa wytwarzana w anterydium łączy się z komórką jajową obecną w oogonium, tworząc grubościenną, kulistą oosporę. Liczba komórek jajowych w oogonium jest cechą taksoniomiczną w rodzaju Saprolegnia. Oospory (o średnicy 15-30 μm) są bardzo wytrzymałe na stresujące warunki, w tym ekstremalne temperatury i stanowią formy przetrwalnikowe, które mogą kiełkować nawet po długim czasie wówczas, gdy warunki staną się bardziej sprzyjające.
W cyklu rozwojowym przeważa bezpłciowa faza diploidalna rozwijająca się z oospor.
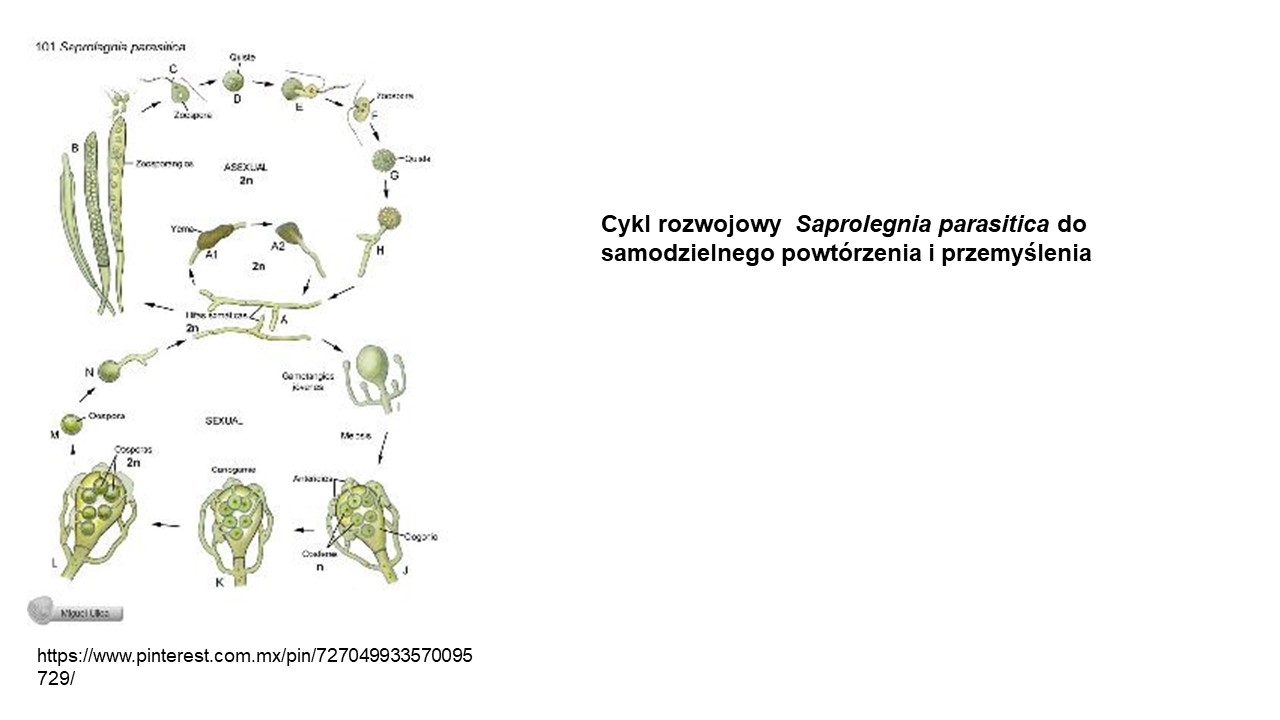
Cykl rozwojowy Saprolegnia parasitica do samodzielnego powtórzenia.
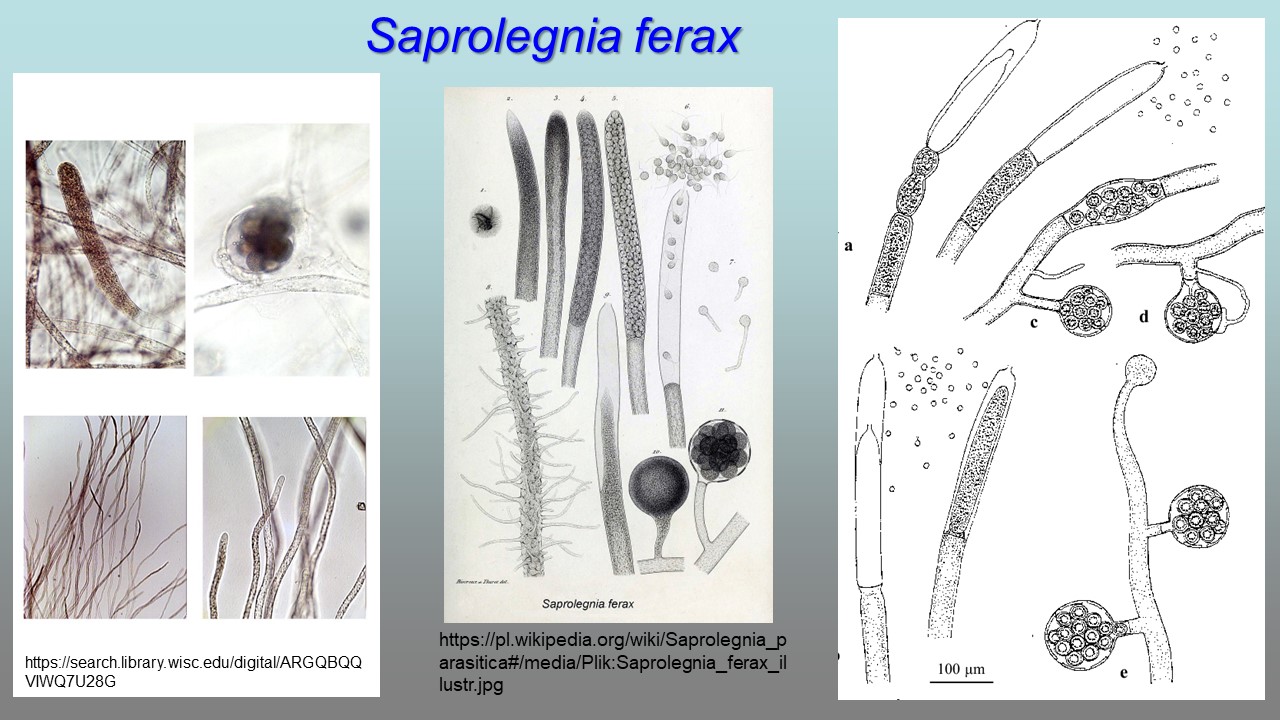
Saprolegnia ferax – grzybnia gęsta; główne strzępki silnie rozgałęzione, szkliste do ciemnych, o szerokości 15–62 µm (średnio 44 µm). Zarodnie obfite, cylindryczne, rzadko wrzecionowate, zawsze proste, odnawiane sympodialnie, 60–490 × 22–78 μm (średnio 352 × 51 µm). Cysty o średnicy 7–11 µm (średnio 10 µm). Gemmy liczne, często nieregularne, tworzące się na końcach strzepek i interkalarne. Oogonia tworzą się końcach strzępek i ich odgałęzianych, czasem interkalarnie, kuliste, grubościenne, o średnicy 76–99 μm, czasem o nieregularnych kształtach. Ściany oogonim gładkie. Odgałęzienia na których tworzą się oogonia często 1–3 razy dłuższe od średnicy oogonium, smukłe i nierozgałęzione. Oospory centryczne, kuliste, po 2–48 w oogonium, o średnicy 15–63 μm. Antheridia bardzo rzadko, jeśli występuje w postaci rozproszonej, 1–5 na oogoniim.
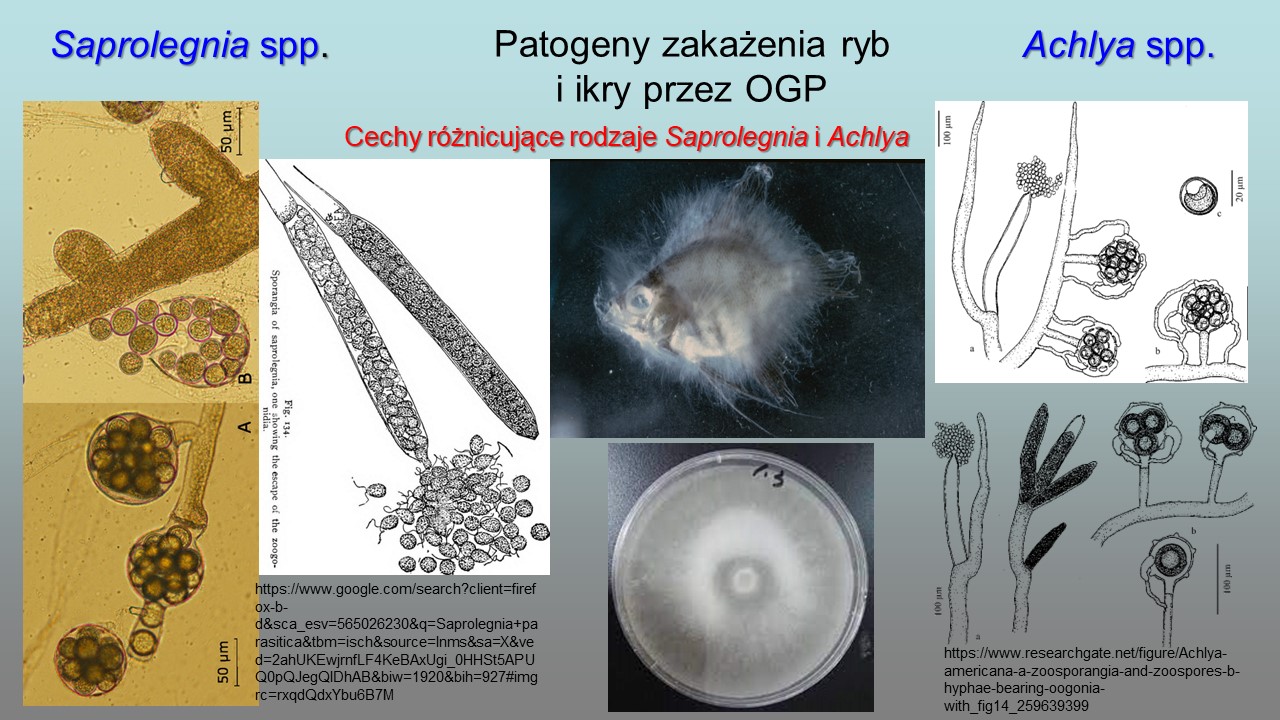
Wzrost grzybni wegetatywnej u przedstawicieli obydwu rodzajów odbywa się w diplofazie, identyfikacja makroskopowa Saprolegnia i Achlya na podstawie grzybni rozwijającej się żywicielu jest niemozliwa. Dopiero diagnostyka mikroskopowa pozwala odróżnić przedstawicieli tych dwóch rodzajów.
Różnice morfologiczno-anatomiczne
1.Zoosporangia Saprolegnia tworzą się w formie maczugowatych, prostych zgrubień na zakończeniach strzępek grzybni i wypełnione są 1-komórkowymi zoosporami.
Pierwotne zoospory Saprolegnia uwalniają się sukcesywnie i odpływają od otworu zoosporangium. Szerokość strzępek grzybni: 15-60 µm
- Zoosporangia Achlya tworzą się zarówno na zakończeniach strzępek grzybni jak i ich rozgałęzieniach, maczugowate, ale często wygięte. Szerokość strzępek grzybni: 70-146 µm
- U Achlya w przeciwieństwie do Saprolegnia w rozwoju bezpłciowym pływki pierwszego stadium są nieruchome i nie mają wici. Poza zarodnią są otorbione.
Grzybnia Achlya powstaje bądź bezpośrednio z oospory (zygota z podwójną ścianą), bądź też z zoospor (pływek zaopatrzonych w 2 wici).
Strzępki grzybni są grube, czasami sztywne, rozgałęzione.
Zarodnie wrzecionowate, cylindryczne lub maczugowate, sympodialnie rozgałęzione.
Pływki wydostają się przez wierzchołkowe pory. Przed odpłynięciem utrzymują się przy zarodni tak długo, aż utworzą kuliste skupiska.
Rozgałęzienie sympodialne (wieloosiowe) powstaje wówczas gdy rozwój szczytu ulega zahamowaniu, a nowy przyrost dokonuje się z części bocznej.
Przeanalizować cykl rozwojowy w zestawieniu z cyklem Saprolegnia. Czy są różnice?
Narybek tilapii nilowej po 3 dniach kontaktu z zoosporami Achlya klebsiana. Strzępki na głowie, płetwie grzbietowej, brzusznej i ogonowej. B: Histopatologia skóry umierającego narybku tilapii, ze strzępkami (oznaczone strzałkami) przyczepionymi do naskórka (PAS). C: Przekrój przez skórę i wybarwione strzępki z niebiesko-białą fluorescencją (oznaczone strzałkami).
Narybek tilapii nilowej po 4 dniach kontaktu z zoosporami A. klebsiana. Oprócz wcześniejszych zmian widoczne strzępki o różowym zabarwieniu (oznaczone strzałki) przerastające mięśnie.
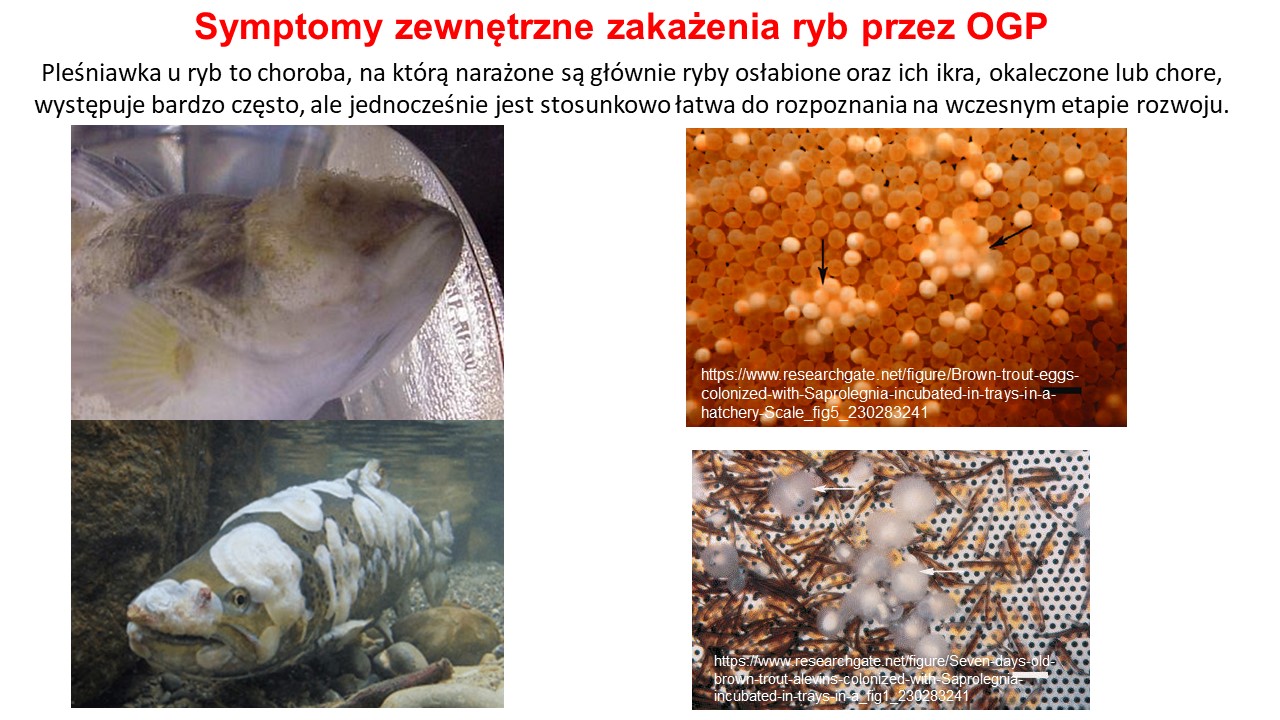
Wszystkie ryby cierpiące z powodu „pleśniawki” wyglądają podobnie – w miejscu uszkodzenia tkanki albo przynajmniej na obszarze pozbawionym śluzu, rozwija się grzybnia w kolorze białym lub brudnoszarym. Może ona tworzyć albo lekki nalot, albo formy zbite, filcowate.
W początkowym stadium OGP rozwijają się wyłącznie w miejscu uszkodzenia skóry, która się odbarwia; jednak stosunkowo szybko grzybnia rozprzestrzenia się na większej powierzchni a nawet sięga głębiej – do tkanki mięśniowej, Ryba cierpiąca na saprolegniazę ma na skórze i skrzelach narośla przypominające bawełnę, odbarwioną skórę i zapadnięte oczy. W cięższych przypadkach mufkowata grzybnia przypomina bawełnę i przerasta do tkanki mięśniowej. W końcu infekuje także skrzela co prowadzi do śmierci.
Jedną z osobliwych i niepożądanych właściwości Saprolegniales jest infekcja niezapłodnionych jaj. Na ikrze ryb saprolegniaza charakteryzuje się obfitym powierzchniowym rozwojem białej, szarej lub brunatnej luźnej grzybni, co prowadzi do zahamowania ich rozwoju i obumierania. Szczególnie podatne na infekcję są jaja zranione, niezapłodnione lub martwe. Jednak, w następnej kolejności, sąsiednie, zapłodnione i zdrowe jaja ulegają także zakażeniu, co niekorzystnie wpływa na zaopatrzenie w tlen i wymianę gazową jaj znajdujących się w ich pobliżu. Natomiast u ryb dorosłych grzybnia osiedla się ogniskowo, i rozwija się na tkankach naskórka, a później skóry właściwej, od głowy lub płetw i rozprzestrzenia się po całej powierzchni ciała, także na oczach, pysku i skrzelach. Nitki przytwierdzonych do ciała strzępek, tworzą unoszący się w wodzie delikatny nalot. Z czasem, luźna i delikatna grzybnia staje się zbita, przypominając wojłokowaty filc. Powierzchniowa infekcja skóry właściwej szybko prowadzi do zaburzenia równowagi płynów i niewydolności krążenia obwodowego z powodu niemożności utrzymania objętości krążącej krwi. Dodatkowo ryby mają zapadnięte oczy i odbarwioną skórę. Zarażone ryby pływają ospale i mogą pozostawać w stanie konania przez kilka dni. Do niedawna uważano, że saprolegnioza nie powoduje głębokich uszkodzeń w mięśniach, ale od niedawna wiadomo, że może rozprzestrzeniać się także na narządy wewnętrzne, takie jak: wątroba, śledziona czy nerki i przewód pokarmowy.
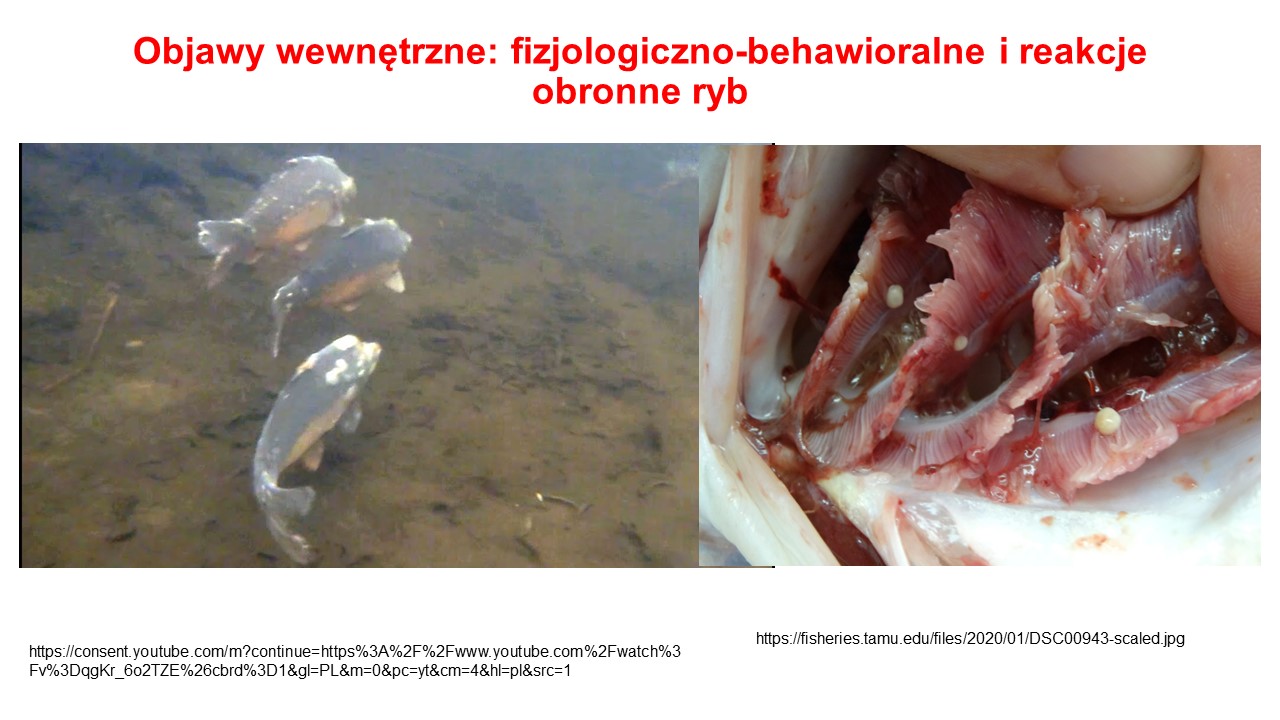
Spadek aktywności oraz podejmowanie prób mechanicznego pozbycia się patogenu poprzez ocieranie się o korzenie, kamienie lub inne podwodne przeszkody.
Spadek częstotliwości żerowania i ilości pobieranego pokarmu.
Zmiany w upodobaniach ekologicznych danego osobnika. np. często chowają się w zakamarkach akwarium tzw. niezdrowa płochliwość ryb, a w przypadku porażenia skrzeli, ryby duszą się, co jest widoczne jako przyspieszony oddech oraz pływanie ryb przy powierzchni wody.
Odpowiedź immunologiczna ryb na infekcję Saprolegnia parasitica.
Po zakażeniu ryby zwiększają ekspresję kilku białek ostrej fazy wraz ze związanym z odpornością transporterem kasetowym wiążącym ATP TAP oraz receptorami cytokin CXCR4 i CD63, niezbędnymi dla odporności humoralnej i rozwoju oraz wzrostu komórek odpornościowych. Uszkodzenia naskórka gospodarza spowodowane infekcją wyzwalają mobilizację makrofagów, które są silnie zaangażowane w początkową odpowiedź immunologiczną m.in. na S. parasitica i są w stanie atakować i niszczyć zoospory i grzybnię. Zazwyczaj S. parasitica wywołuje silną odpowiedź zapalną gospodarza poprzez indukcję czynnika martwicy nowotworów alfa (TNF-α) wraz z aktywacją wrodzonych składników komórkowych, takich jak cyklooksygenaza-2 (COX-2), peptydy przeciwbakteryjne i lektyny. S. parasitica może powodować immunomodulację gospodarza poprzez regulację redukującą adaptacyjne składniki odporności, w tym cytokin pomocniczych komórek T, antygenu i immunoglobulin. Ponadto S. parasitica wytwarza metabolit, prostaglandynę E 2, który hamuje ekspresję interferonu-γ (IFN-γ) i białka indukowanego przez IFN-γ (γ-IP), kluczowych czynników w odporności komórkowej.
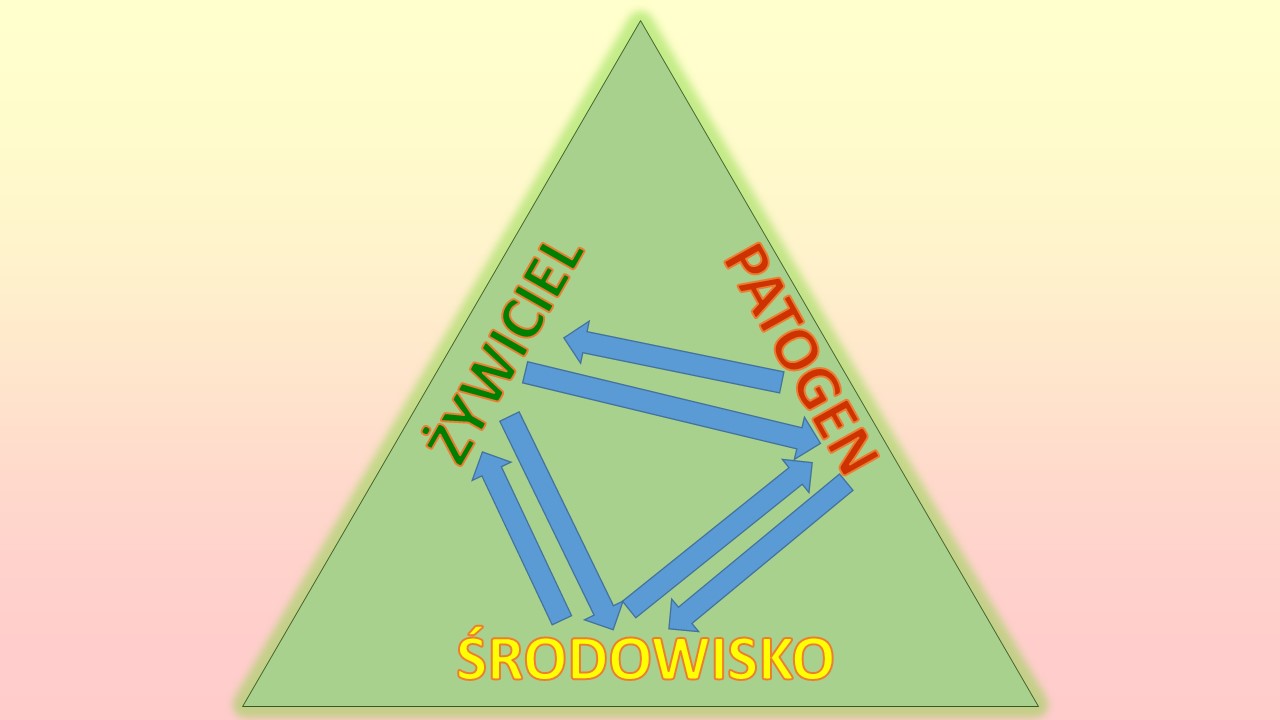
Warunkiem zakażenia i rozwoju procesu chorobowego jest jednoczesne występowanie trzech czynników (tzw. triada infekcyjna), czyli: występowanie żywiciela wrażliwego na obecność wirulentnego patogenu w środowisku. Stąd też czynniki zewnętrzne (abiotyczne lub biotyczne) które mogą długotrwałe zakłócać funkcje fizjologiczne żywiciela, prowadzą do zmian (objawów) chorobowych, a w sprzyjających warunkach środowiskowych także mogą zagrażać życiu lub normalnemu funkcjonowaniu żywiciela.
W tej triadzie infekcyjnej rozpatruje się sekwencje akcji patogenu i reakcji żywiciela oraz swoiste oddziaływanie patogenu i żywiciela, zachodzące w określonych warunkach środowiska.
Saprolegnioza jest chorobą uciążliwą głównie dla ryb łososiowatych, od ikry po osobniki dorosłe. Wiedza na temat czynników abiotycznych i biotycznych wpływających na występowanie i rozprzestrzenianie się S. parasitica pochodzi albo z badań akwakultury, skupiających się na zdrowiu gospodarza, albo z badań mikrobiologicznych in vitro. Stresujące warunki często spotykane w obiektach akwakultury (np. szok temperaturowy, zakażenie bakteriami i grzybami, stres spowodowany przegęszczeniem lub urazem) mogą osłabić układ odpornościowy żywiciela i zwiększyć jego podatność na S. parasitica. Z drugiej strony badania laboratoryjne wykazały, że produkcja zoospor zmniejsza się, gdy temperatura wody wzrasta powyżej 20 °C, a ich kiełkowanie jest hamowane w warunkach kwaśnych (pH < 4,5). Substancje humusowe, które stanowią większość rozpuszczonej materii organicznej w oligotroficznych ekosystemach słodkowodnych, mogą hamować wzrost grzybni patogenu, natomiast jony Ca2+ regulują procesy takie jak adhezja, otorbienie i kiełkowanie zoospor.
Pomimo licznych badań laboratoryjnych, wiedza na temat rozprzestrzeniania S. parasitica w środowisku naturalnym jest bardzo ograniczona, co uniemożliwia określenie zasięgu występowania patogenu oraz analizę parametrów ekologicznych, które mogłyby mieć wpływ na jego występowanie. Określenie związku między stanem ekologicznym i fizykochemicznym wód naturalnych a występowaniem S. parasitica ma kluczowe znaczenie dla wszelkich prób przewidywania możliwości wybuchu choroby w warunkach naturalnych.
Przy zbyt niskiej temperaturze dla danego gatunku ryb na uszkodzone powłoki zewnętrzne ryby dostają się zoospory. Zoosporowe OGP są aktywne przy niższej temperaturze wody (5-15 st.C).
W wyższej temperaturze rozwijają się wolniej, a ich cykle rozwojowe często ulegają modyfikacji i uproszczeniu.
Gatunki Achlya w wyższych temperaturach skąpo zarodnikują, nie wytwarzają też lęgni i plemni.
Saprolegnia i Achlya nie wytrzymują też w wyższej temperaturze konkurencji z bakteriami i glonami, zwłaszcza osiadłymi, a ich liczebna redukcja sprawia, że rola w ekosystemie także spada.
Temperatura
W okresie od V do XI/XII w strefie profundalnej jezior jest deficyt tlenu, co sprawia że brak również OGP (poza Pythium sp.)
W okresie stagnacji zimowej kiedy w strefie profundalnej jest więcej tlenu, również izoluje się więcej gatunków OGP, w tym Achlya, Saprolegnia i Aphanomyces
Bezpośredni wpływ światła na życie OGP polega na nagrzewaniu wody i oddziaływaniu przez zmianę temperatury i stężenia tlenu. Istotniejszym jest jednak wpływ pośredni, w którym intensywne oświetlenie zbiornika wzmaga wzrost i rozwój
glonów, które wstępują z OGP w rywalizację o podłoże, zwłaszcza, że szereg z glonów wytwarza substancje fungistatyczne, ograniczające rozwój OGP na zasadzie konkurencji i antybiozy.
Dotychczas stwierdzono jedynie wpływ światła na Saprolegnia ferax , co objawiało się wstrzymaniem tworzenia lęgni i oospor oraz modyfikacją morfogenezy, jednak bez wpływu na intensywnośc wzrostu.
Dodatkowym elementem sprzyjającym zakażeniu jest stres manipulacyjny czy zmęczenie po transporcie. Uszkodzenie ciała ryby może powstać zarówno na skutek nieprawidłowych czynników fizykochemicznych (np. zbyt niski lub wysoki odczyn), ataku pasożytów (np. splewki, pijawki) czy zranień mechanicznych.
Ryby słodkowodne stanowią jeden z największych zasobów naturalnych świata. Niestety ekspansywna i niekontrolowana działalność antropogeniczna, łącznie z konsekwencjami zmian klimatycznych, wpływają niekorzystnie na ekosystemy wodne, co powoduje zagrożenie dla wielu gatunków ichtiofauny. Ich rezerwuarem staje się akwakultura, która stanowi ponad 50% całkowitej produkcji ryb i jest jednym z najszybciej rozwijających się sektorów żywności na świecie (FAO, 2012; Van West, 2006). Rozwój tego sektora jest często hamowany i zakłócany w związku ze złymi warunkami sanitarnymi. Istotną ich przyczyną jest obecność wielu szkodliwych dla ryb czynników biologicznych, takich jak: wirusy, bakterie oraz występujące równie często pierwotniaki, przywry i patogeniczne organizmy grzybopodobne (OGP), powodujące redukcję populacji różnych gatunków ryb.
Badania nad patogenami saprolegniozy skupiają się głównie na ich negatywnym wpływie na akwakulturę, ponieważ są to patogeny najbardziej odpowiedzialne za straty ekonomiczne w hodowlach ryb łososiowatych i wylęgarniach na całym świecie gdzie powodują straty przekraczające 10%. W przypadku hodowli łososia atlantyckiego (szlachetny), pstrąga tęczowego i potokowego oraz innych niż łososiowate gatunków ryb, w tym m.in. okonia i węgorza straty szacowane są na miliardy dolarów, a w odniesieniu do amurów i sumów hodowanych, są wprawdzie mniej dotkliwe, ale również powodują corocznie milionowe straty. Ponieważ hodowle ryb w akwakulturach mogą stanowić skupiska patogenów, z których głównie S. parasitica rozprzestrzenia się do środowiska naturalnego, mają też istotny, potencjalnie negatywny wpływ na dzikie populacje łososiowatych i innych hydrobiontów. W tych warunkach szkodliwość i znaczenie saprolegniozy pozostają w dużej mierze niezbadane, chociaż odnotowywane spadki liczebności populacji dzikiego łososia, wynikają często z infekcji przez OGP z rzędu Saprolegniales.
Zwalczanie saprolegniazy tradycyjnie oparte było na wykorzystaniu zieleni malachitowej. Od 2002 r., czyli czasu międzynarodowego zakazu stosowania tego związku, ze względu na jego udowodnione działanie rakotwórcze, mutagenne i teratogenne powstała pilna potrzeba opracowania alternatywnych metod zwalczania saprolegniazy. Zieleń malachitowa mimo tego, że skutecznym środkiem grzybobójczym, została zakazana w leczeniu ryb jadalnych, a pozostałe substancje zawierające głównie siarczan miedzi lub chlorek miedzi jako skuteczne środki, mogą nawet w małych dawkach być śmiertelne dla wielu bezkręgowców i niektórych gatunków ryb, choć stosuje się je w akwarystyce.
Inne testowane środki, takie jak formalina i formaldehyd (Gieseker et al. 2006), chlorek sodu (Ali 2009), nadtlenek wodoru (Barnes i in. 1998). kwas borowy (Ali et al. 2014), klotrimazol (Warrilow et al. 2014), azotan miedzi czy nadmanganian potasu są proponowane do leczenia zakażeń patogenami wywołującymi saprolegniozę, jednak bezpieczeństwo biologiczne i wpływ tych chemikaliów na środowisko są wątpliwe (Ali i in., 2014).
Ze względu na wysokie koszty ekonomiczne, także ozonowanie wody (Forneris i in. 2003), mimo skuteczności w zwalczaniu zachorowań na saprolegniazę, utrudnia powszechne zastosowanie tego zabiegu.
Pilna potrzeba znalezienia skutecznych, opłacalnych i bezpiecznych środków terapeutycznych, zintensyfikowała prace nad poszukiwaniem alternatywnych metod. Duże nadzieje wiąże się w tym zakresie z kontrolą biologiczną, która uznawana jest za przyjazną dla środowiska alternatywną strategię, wykorzystującą w redukcji patogenów inne antagonistycznie działające mikroorganizmy. Czynniki te poprawiają odporność niespecyficzną i wspomagają pozyskiwanie składników odżywczych przez gatunki hodowane w akwakulturze. Jako obiecujące do zwalczania saprolegniazy w akwakulturze opisano liczne probiotyki, produkowane przez mikroorganizmy. Na przykład codzienne dodawanie Aeromonas media szczep A199 do wody w hodowli akwakultury skutecznie zatrzymało rozwój saprolegniazy u ryb, dzięki antagonistycznemu działaniu substancji hamującej, podobnej do bakteriocyny.
W ostatnich latach stwierdzono, że nowy związek Quellenin, syntetyzowany przez Aspergillus sp. szczep YK-76 działa także hamująco na wzrost i rozwój Saprolegnia (Takahashi i in., 2018). Antagonizm wobec Saprolegnia wykazują także inne gatunki grzybów np. głębinowy Penicillium coralligerum YK-247, w związku z produkcją fungistatycznej substancji – Cladomarine (Takahashi i in., 2017) oraz słodkowodny gatunek Burkholderia szczep HD05, z którego wyekstrahowano i oczyszczono pochodną kwasu glutaminowego, udowadniając antagonistyczną aktywność tej substancji wobec Saprolegnia. Probiotyki te stanowią obiecujący potencjał dla biologicznego zwalczania saprolegniozy w akwakulturze.
W leczeniu saprolegniozy, optymizmem napawają również badania genomiczne i proteomiczne S. parasitica i innych patogennych lęgniowców, które uzupełniają identyfikację genów i białek zaangażowanych w odpowiedź immunologiczną chorych ryb żywicielskich z saprolegniazą. Badania nad produkcją swoistych przeciwciał zaangażowanych w odpowiedź immunoregulacyjną u ryb żywicielskich zakażonych saprolegniazą mogą pomóc w opracowaniu szczepionki i wczesnym wykrywaniu S. parasitica. Fregeneda-Grandes i in. (2007) wstrzyknęli pstrągowi potokowemu (Salmo trutta) ekstrakty antygenowe z patogennego S. parasitica i wykryli w surowicy tej ryby swoiste przeciwciała wytwarzane w odpowiedzi na saprolegniazę. Test immunoenzymatyczny (ELISA), immunofluorescencyjny (IF) i analizy Western blotting (WB) zastosowano do analizy obecności przeciwciał w surowicy. Przeciwciała te wykryto odpowiednio w 66,7%, 54,5% i 48,5% próbek surowicy, dla każdej z trzech wymienionych technik. Tak więc, wytwarzanie swoistych przeciwciał przez S. trutta w odpowiedzi na ekstrakty antygenowe z S. parasitica można wykrywać standardowymi technikami immunologicznymi. Fregeneda-Grandes i in. (2009) analizowali u dzikiego i hodowlanego S. trutta, częstość występowania w surowicy przeciwciał, skierowanych przeciwko S. parasitica za pomocą testu ELISA. Próbki S. trutta pobierano przez okres dwóch lat w miesiącach styczeń, kwiecień i sierpień. Autorzy ci stwierdzili dodatnią korelację między poziomem wytwarzanych przeciwciał w surowicy a większymi (starszymi) rybami. Odkrycie to wskazuje, że wraz z wiekiem ryb narażonych na S. parasitica ich odpowiedź immunologiczna zwiększa się. Niższa liczba swoistych przeciwciał w surowicy S. trutta w odpowiedzi na ekspozycję na Saprolegnia może wskazywać na supresję immunologiczną wywołaną przez S. parasitica (Kales i wsp. 2007; Fregeneda-Grandes i wsp. 2009). Stąd też konieczne są przyszłe badania charakteryzujące wytwarzanie antygenu, aby lepiej zrozumieć specyficzną odpowiedź immunologiczną u ryb zakażonych Saprolegnia.
Skuteczne zwalczanie saprolegniazy jest jednym z głównych wyzwań w akwakulturze. Ogromne straty ekonomiczne powodowane przez infekcje wywołane przez OGP wymuszają konieczność ciągłych badań dotyczących ekologii, rozprzestrzeniania i patogenezy saprolegniozy. Stanowi to punkt wyjścia w celu opracowania metod strategii skutecznego zapobiegania i zwalczania saprolegniozy. Podstawą tych zabiegów ochronnych jest potrzeba szybkiej rozbudowy i doskonalenia systemów identyfikacji. Diagnostykę i charakterystykę poszczególnych gatunków istotnie poprawia znaczny postęp w genomice Saprolegnia, związany z udostępnieniem sekwencji całych genomów, transkryptomów, genów kodów kreskowych i genów patogennych Saprolegnia. W Polsce, niestety ciągle dominują tradycyjne metody diagnostyczne oparte na wykorzystaniu cech morfologicznych i fizjologicznych. Fakt ten sprawia, że mimo opracowanych i dostępnych, szybkich technik biochemicznych, opartych na nowatorskich badaniach molekularnych, potencjał ich powszechnego wykorzystania jest minimalny, a skuteczność identyfikacji ograniczona.
OGP z wody naturalnych zbiorników izoluje się za pomocą materiałów „pułapkowych” takich jak:
- nasiona konopi lub sezamu,
- wysuszone kiełże,
- fragmenty skóry węża lub krewetki
- obumarłe, wyschnięte owady
„pułapki” te umieszcza się w przezroczystych, plastikowych cylindrach plastikowych, których ściany: wylotową i wylotową należy zamknąć poliamidową gazą młyńską o wielkości oczka 50-150µm. Do cylindrów (na zewnątrz) przyczepia się sznurek wraz z obciążającym kamieniem z jednej strony i pływakiem ze styropianu z drugiej strony i umieszcza się w zbiorniku.
Izolacja OGP z „pułapek”
1.Białą grzybnię rozwijającą się na „pułapce” należy w laboratorium umieścić w naczyniach z napowietrzaną wodą mineralną, do której ponownie dodaje się nowe „pułapki”
2.Po pojawieniu się grzybni na „pułapkach” należy odciąć jej fragment i umieścić na podłożu agarowym PDA, SAB, MEA
3.Rozwój grzybni na szalkach Petriego trwa od 3-14 dni w temp. 10-15oC.
4.Po tym czasie wykonuje się preparaty mikroskopowe w błękicie metylenowym i obserwuje się cechy morfologiczno- anatomiczne niezbędne do oznaczenia taksonomicznego
5.Do oznaczeń polecane są liczne klucze np.:
a/ Batko A. 1975. Zarys hydromikologii. PWN, Warszawa
b/ Khulbe R.D. 2001. A manual of aquatic fungi. Daya Publishing House
c/ Riethmuller A. 2000. Morphologie, Okologie und Phylogenie aquatischer
Oomyceten. Bibliotheca Mycologica Band 185
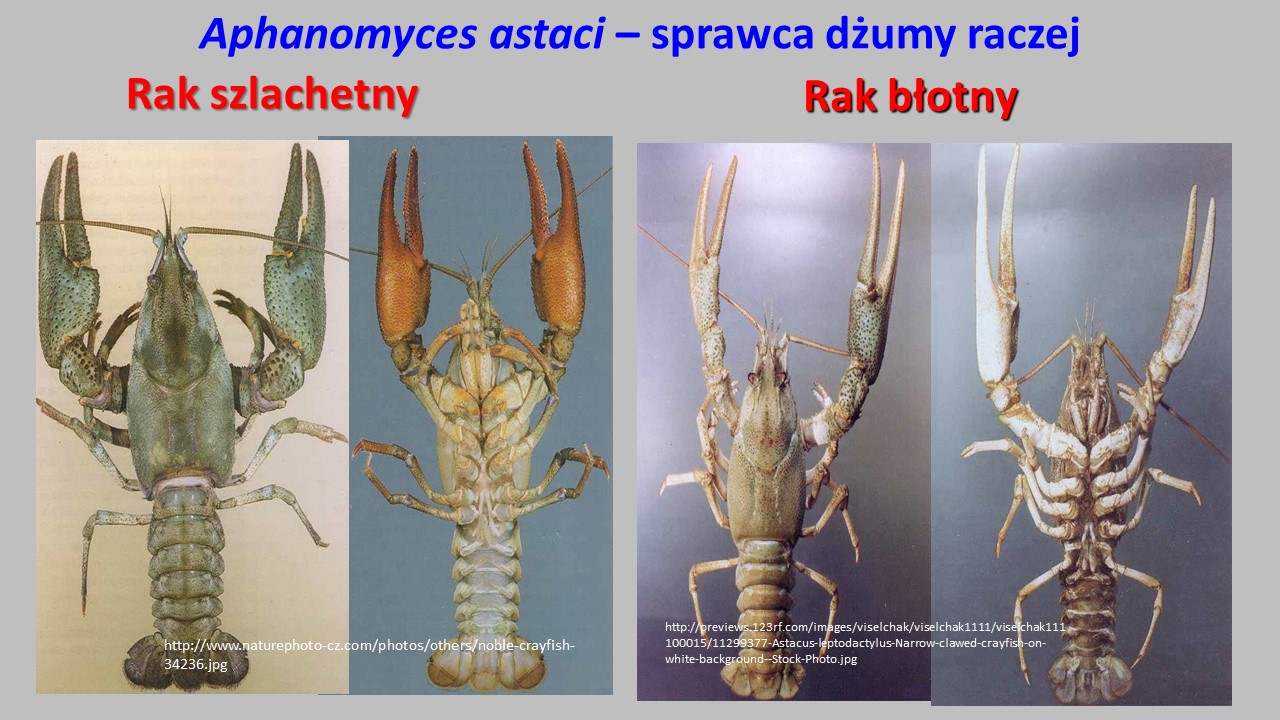
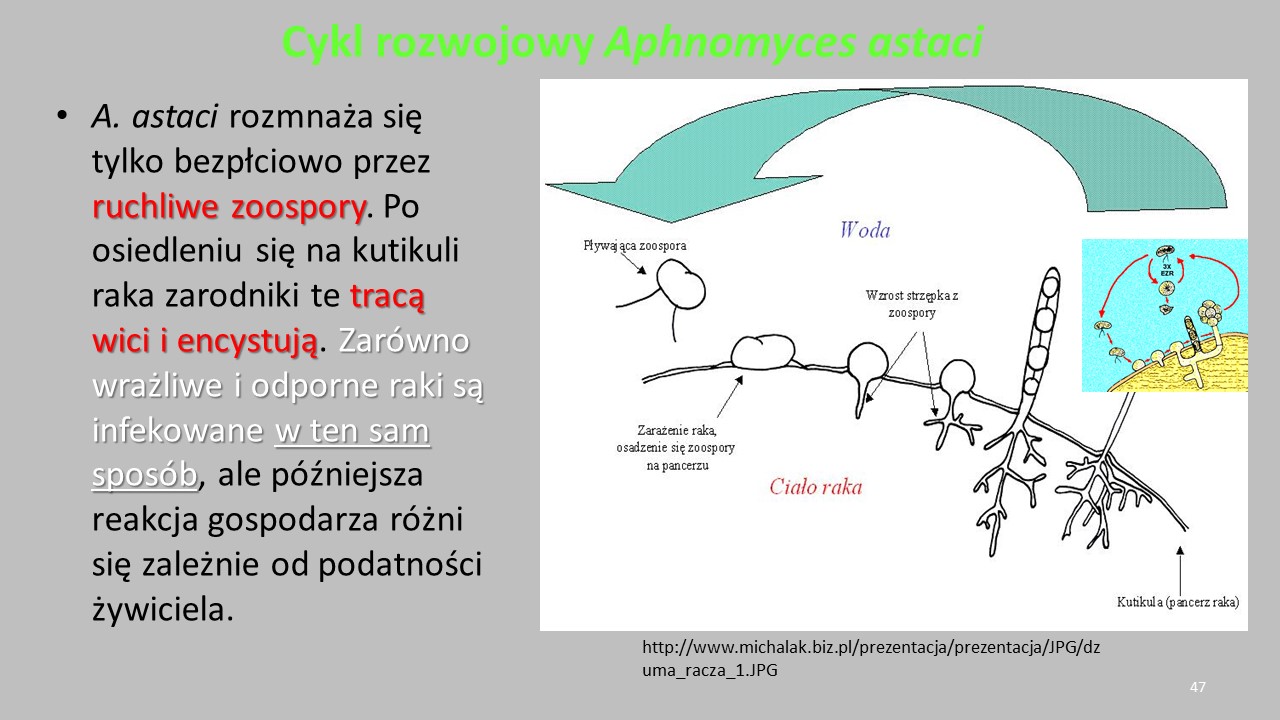
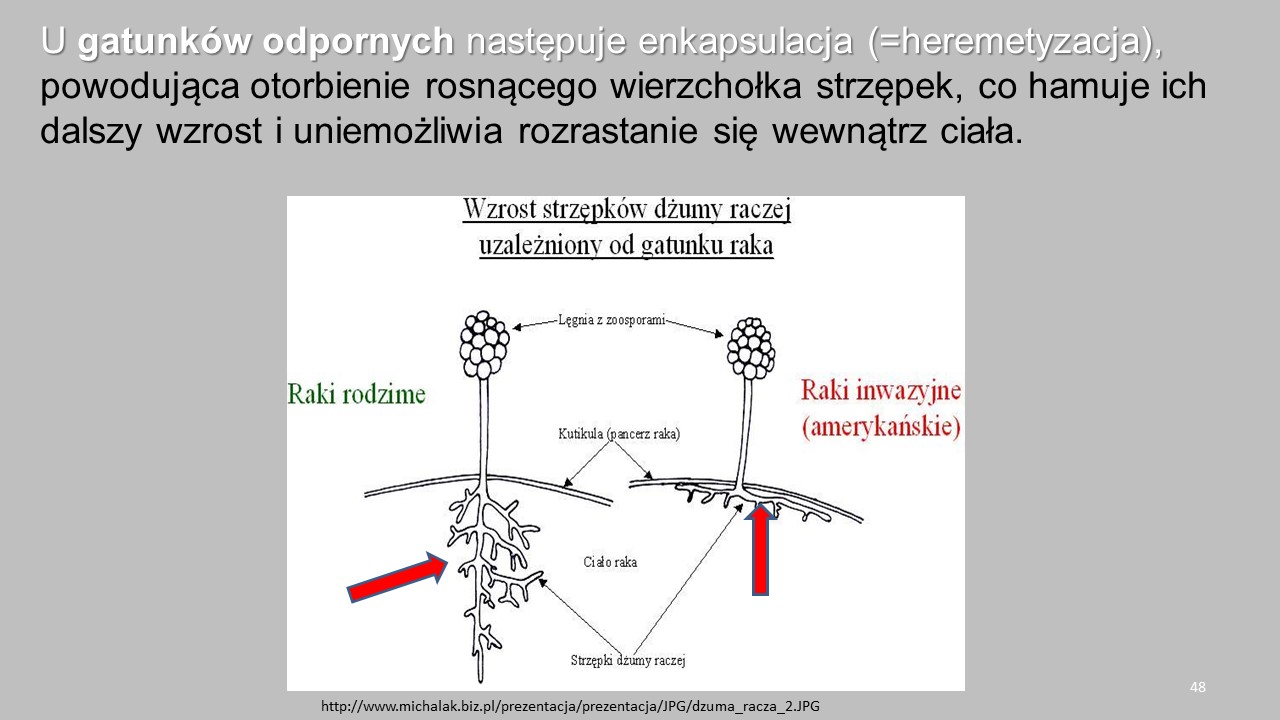
OGP powodują infekcje i choroby nie tylko ryb ale także licznych bezkręgowców. W Polsce bardzo poważnym problemem jest Aphanomyces astaci – sprawca dżumy raczej, śmiertelnej choroby dla rodzimych raków europejskich. Ten monofag infekuje i rozwija się w populacjach rodzimych raków: raka szlachetnego (=rzeczny, szerokoszczypcowy, szewc) i raka błotnego (=stawowy, długoszczypcowy, krawiec), natomiast gatunki introdukowane (rak pręgowaty i sygnałowy) są jego nosicielami.
Patogen dostał się do Europy w 1860 roku z wodami balastowymi statku płynącego z Ameryki Północnej do Włoch. Szybko rozpowszechnił się w Europie, powodując masowe śnięcia raków.
W celu zastąpienia rodzimych gatunków raków sprowadzono w latach 50. i 60. z Ameryki Północnej raka pręgowatego i sygnałowego. Te introdukcje, w większości przeprowadzane przez prywatnych hodowców, spowodowały rozpowszechnienie się choroby, ponieważ amerykańskie raki są jej nosicielami.
Rak sygnałowy (Pacifastacus leniusculus) z melanizowanymi plamkami (reakcja układu odpornościowego) na pancerzu (a) i miękki naskórek brzucha (b) spowodowany infekcją Aphanomyces astaci.